题目内容
【题目】铬是一种银白色金属,化学性质稳定,在化合物中常见![]() 、
、![]() 和
和![]() 价等价态。工业上以铬铁矿
价等价态。工业上以铬铁矿![]() 主要成分为
主要成分为![]() ,含有
,含有![]() 、
、![]() 等杂质
等杂质![]() 为主要原料生产金属铬和重铬酸钠
为主要原料生产金属铬和重铬酸钠![]() 已知
已知 ![]() 是一种强氧化剂
是一种强氧化剂![]() ,其主要工艺流程如下:
,其主要工艺流程如下:
查阅资料得知:常温下,![]() 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将![]() 转化为
转化为![]()
回答下列问题:
![]() 工业上常采用热还原法制备金属铬,写出以
工业上常采用热还原法制备金属铬,写出以![]() 为原料,利用铝热反应制取金属铬的化学方程式_______________。
为原料,利用铝热反应制取金属铬的化学方程式_______________。
![]() 酸化滤液D时,不选用盐酸的原因是_____________。
酸化滤液D时,不选用盐酸的原因是_____________。
![]() 固体E的主要成分是
固体E的主要成分是![]() ,根据如图分析操作a为________________、____________、洗涤、干燥。
,根据如图分析操作a为________________、____________、洗涤、干燥。
![]() 已知含
已知含![]() 价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的
价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的![]() 。
。
![]()
![]() 的化学性质与
的化学性质与 ![]() 相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________
相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________![]() 用离子方程式表示
用离子方程式表示![]() ;
;
![]() 下列溶液中可以代替上述流程中
下列溶液中可以代替上述流程中![]() 溶液最佳的是___________
溶液最佳的是___________![]() 填选项序号
填选项序号![]() ;
;
A ![]() 溶液
溶液 ![]() 浓
浓![]()
![]() 酸性
酸性![]() 溶液
溶液 ![]() 溶液
溶液
![]() 上述流程中,每消耗
上述流程中,每消耗![]() 转移
转移![]() ,则加入
,则加入![]() 溶液时发生反应的离子方程式为_____________。
溶液时发生反应的离子方程式为_____________。
![]() 某厂废水中含
某厂废水中含![]() 的
的![]() ,某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 ![]() 的化合价为
的化合价为![]() ,Fe的化合价依次为
,Fe的化合价依次为![]() 、
、![]() 。欲使1L该废水中的
。欲使1L该废水中的 ![]() 完全转化为
完全转化为![]() 。理论上需要加入________
。理论上需要加入________![]() 。
。
![]() 已知
已知![]() 摩尔质量为
摩尔质量为![]()
【答案】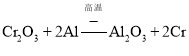
![]() 会氧化
会氧化![]() 生成氯气,造成污染 蒸发结晶 趁热过滤
生成氯气,造成污染 蒸发结晶 趁热过滤 ![]()
![]()
![]()
![]()
【解析】
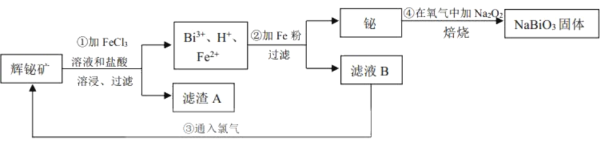
根据流程:铬铁矿![]() 主要成分为
主要成分为![]() ,含有
,含有![]() 、
、![]() 等杂质
等杂质![]() 用过量的硫酸酸浸,
用过量的硫酸酸浸,![]() 不溶,过滤,固体A为
不溶,过滤,固体A为![]() ,溶液A为含有
,溶液A为含有![]() 、
、![]() 、
、![]() 的酸性溶液,加入过量过氧化氢氧化
的酸性溶液,加入过量过氧化氢氧化![]() 为
为![]() ,调节pH除去
,调节pH除去![]() ,溶液C含有
,溶液C含有![]() 、
、![]() ,加入过量
,加入过量![]() ,NaOH,在碱性条件下,能将
,NaOH,在碱性条件下,能将![]() 转化为
转化为![]() ,
,![]() 沉淀,滤液D含有
沉淀,滤液D含有,加入硫酸酸化得到含有的
![]() 和
和![]() 的溶液,蒸发结晶,趁热过滤、洗涤、干燥得到
的溶液,蒸发结晶,趁热过滤、洗涤、干燥得到![]() ,以此解答此题。
,以此解答此题。
根据上述分析可知:
![]() 利用铝热反应制取金属铬的化学方程式:
利用铝热反应制取金属铬的化学方程式: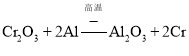 ;
;
故答案为: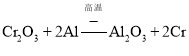 ;
;
![]() 是一种强氧化剂,
是一种强氧化剂,![]() 会氧化
会氧化![]() 生成氯气,造成污染,故酸化滤液D时,不选用盐酸;
生成氯气,造成污染,故酸化滤液D时,不选用盐酸;
故答案为:![]() 会氧化
会氧化![]() 生成氯气,造成污染;
生成氯气,造成污染;
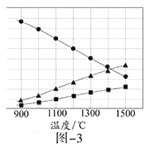
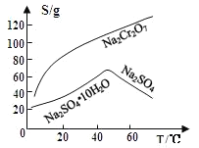
![]() 由图2可知
由图2可知![]() 的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠;
的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠;
故答案为:蒸发结晶;趁热过滤;
![]() 的化学性质与
的化学性质与![]() 相似,如果氢氧化钠过量
相似,如果氢氧化钠过量![]() 会溶解,发生离子方程式为:
会溶解,发生离子方程式为:![]() ;
;
故答案为:![]() ;
;
![]() 可以代替上述流程中
可以代替上述流程中![]() 溶液,需要具有还原性,能还原重铬酸根离子;
溶液,需要具有还原性,能还原重铬酸根离子;
A.![]() 溶液中亚铁离子具有还原性,可以还原
溶液中亚铁离子具有还原性,可以还原![]() 离子,但又引入新的杂质离子铁离子,故A不符合;
离子,但又引入新的杂质离子铁离子,故A不符合;
B.浓![]() 具有强氧化性,不能表现还原性,不能还原
具有强氧化性,不能表现还原性,不能还原![]() ,故B不符合;
,故B不符合;
C.酸性![]() 是强氧化剂不能还原
是强氧化剂不能还原![]() ,故C不符合;
,故C不符合;
D.![]() 溶液中亚硫酸根离子具有还原性,可以还原
溶液中亚硫酸根离子具有还原性,可以还原![]() ,故D符合;
,故D符合;
故答案为:D;
![]() 每消耗
每消耗![]() 转移
转移![]() ,
,![]() ,
,![]() ,依据氧化还原反应电子守恒配平书写,
,依据氧化还原反应电子守恒配平书写,![]() ,
,![]() ,得到的氧化还原反应的离子方程式为
,得到的氧化还原反应的离子方程式为![]() ;
;
故答案为:![]() ;
;
![]() 根据
根据![]() 中,Cr:
中,Cr:![]() :
:![]() :5;故有
:5;故有![]() ,故质量为
,故质量为![]() ;
;
故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案