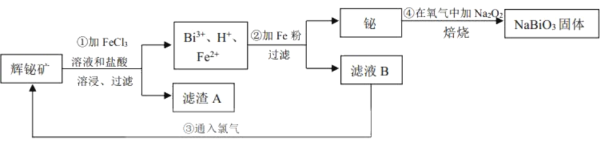
题目内容
【题目】海洋经济已经成为拉动我国国民经济发展的重要引擎,海水的综合开发、利用是海洋经济的一部分,海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。其流程如图所示:
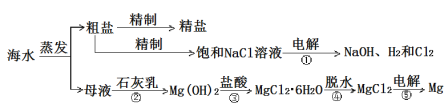
(1)写出镁原子的结构示意图:_______。在反应①→⑤中属于氧化还原反应的是______。(填序号)
(2)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、________溶液;③_________;④滤液中加适量盐酸;⑤__________。(请补全缺少的实验步骤或试剂)
(3)某同学利用反应①原理制备氯气,将400 mL 5.0 mol·L-1NaCl溶液进行电解,则理论上最多可制得标准状况下氯气的体积为_____L。
(4)实验室模拟Mg的制取流程时,用11.3 mol·L-1的浓盐酸配置反应③所需要的0.5 mol·L-1稀盐酸100 ml,需要用量筒量取浓盐酸________ml,接下来的配置过程除了玻璃棒和烧杯外,还需要用到的玻璃仪器有_______。
【答案】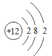 ①⑤ Na2CO3 过滤 蒸发结晶 22.4 4.4 胶头滴管、100ml容量瓶
①⑤ Na2CO3 过滤 蒸发结晶 22.4 4.4 胶头滴管、100ml容量瓶
【解析】
(1)镁离子质子数为12,核外电子数为10,有2个电子层,各层电子数为2、8;有元素化合价发生变化的反应属于氧化还原反应,结合具体反应判断;
(2)镁离子与氢氧根离子生成氢氧化镁沉淀;钙离子与碳酸根反应生成碳酸钙沉淀;
(3)根据n=cV计算NaCl的物质的量,结合方程式计算生成氯气的体积;
(4)根据配制一定物质的量浓度溶液需要仪器分析。
(1)镁的质子数为12,镁原子结构示意图为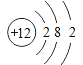 ;反应①是电解食盐水生成氢氧化钠、氯气与氢气,属于氧化还原反应,反应②是溶液中镁离子与石灰乳反应生成氢氧化镁沉淀,属于非氧化还原反应,反应③是氢氧化镁与盐酸反应,属于非氧化还原反应,反应④是氯化镁晶体失去结晶水得到氯化镁,属于非氧化还原反应,反应⑤是电解熔融氯化镁生成镁与氯气,属于氧化还原反应,
;反应①是电解食盐水生成氢氧化钠、氯气与氢气,属于氧化还原反应,反应②是溶液中镁离子与石灰乳反应生成氢氧化镁沉淀,属于非氧化还原反应,反应③是氢氧化镁与盐酸反应,属于非氧化还原反应,反应④是氯化镁晶体失去结晶水得到氯化镁,属于非氧化还原反应,反应⑤是电解熔融氯化镁生成镁与氯气,属于氧化还原反应,
故答案为: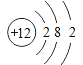 ;①⑤;
;①⑤;
(2)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后过滤,向滤液加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,因此为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③过滤;④滤液中加适量盐酸;⑤蒸发结晶,故答案为:Na2CO3;过滤;蒸发结晶;
(3)400mL5molL-1NaCl溶液中NaCl的物质的量=0.4L×5mol/L=2mol,由2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑可知生成氯气为2mol×1/2=1mol,标况下,生成氯气的体积=1mol×22.4L/mol=22.4L,
2NaOH+Cl2↑+H2↑可知生成氯气为2mol×1/2=1mol,标况下,生成氯气的体积=1mol×22.4L/mol=22.4L,
故答案为:22.4;
(4)由于稀释过程中溶质的物质的量不变,则需要用量筒量取浓盐酸的体积为![]() ≈4.4mL;用浓盐酸配制稀盐酸的一般步骤分别是计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要的仪器除了量筒、玻璃棒和烧杯外,还需要用到的玻璃仪器有胶头滴管、100mL容量瓶,
≈4.4mL;用浓盐酸配制稀盐酸的一般步骤分别是计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要的仪器除了量筒、玻璃棒和烧杯外,还需要用到的玻璃仪器有胶头滴管、100mL容量瓶,
故答案为:4.4;胶头滴管、100mL容量瓶。