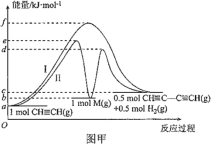
题目内容
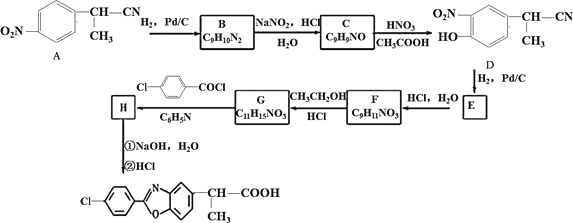
【题目】氨甲环酸(G)别名止血环酸,是一种已被广泛使用半个世纪的止血药,它的一种合成路线如下(部分反应条件和试剂略):
回答下列问题:
(1)A的结构简式是____。C的化学名称是_______。
(2)G在NaOH催化下发生双分子脱水形成仅含两个环的有机物,写出该反应的化学反应方程式____。
(3)①~⑥中属于取代反应的是_________。
(4)E中不含N原子的官能团名称为___________。
(5)氨甲环酸(G)的分子式为__________。
(6)满足以下条件的所有E的同分异构体有_____种。
a.含苯环 b.含硝基 c.苯环上只有两个取代基
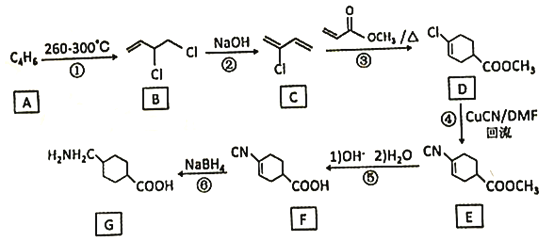
(7)写出以![]() 和CH2=CHCOOCH2CH3为原料,制备
和CH2=CHCOOCH2CH3为原料,制备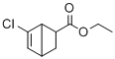 的合成路线:_______(无机试剂任性)
的合成路线:_______(无机试剂任性)
【答案】CH2=CHCH=CH2 2-氯-1,3-丁二烯 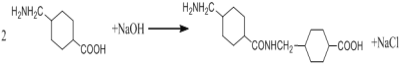 ④⑤ 酯基、碳碳双键 C8H15O2N 15
④⑤ 酯基、碳碳双键 C8H15O2N 15 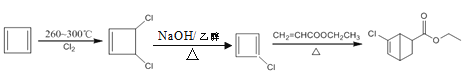
【解析】
根据A分子式及B结构简式知,A为CH2=CHCH=CH2,A→B的反应为加成反应;B发生消去反应生成C,C发生加成反应生成D,D发生取代反应生成E,E发生水解反应生成F,F发生还原反应生成G。
(7)以![]() 和为CH2=CHCOOCH2CH3原料制备
和为CH2=CHCOOCH2CH3原料制备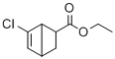 ,
,![]() 先发生加成反应生成
先发生加成反应生成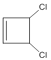 ,然后
,然后 发生消去反应生成
发生消去反应生成 ,
, 再与CH2=CHCOOCH2CH3发生加成反应生成目标产物。
再与CH2=CHCOOCH2CH3发生加成反应生成目标产物。
(1)根据A的分子式及A与Cl2在260—300℃时发生加成反应产生B,根据B的结构简式可知A结构简式是CH2=CHCH=CH2;C的结构简式是![]() ,选择含有2个碳碳双键在内的碳链为主链,把-Cl原子作取代基,给机物命名,可知C的化学名称是2-氯-1,3-丁二烯;
,选择含有2个碳碳双键在内的碳链为主链,把-Cl原子作取代基,给机物命名,可知C的化学名称是2-氯-1,3-丁二烯;
(2)G结构简式是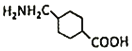 ,G分子中含有-COOH和-NH2,在NaOH催化下发生分子之间的取代反应,一个分子的羧基脱去-OH,另一个分子的氨基脱去H原子,羟基与氢原子结合形成H2O,剩余部分结合在一起形成含两个环的有机物
,G分子中含有-COOH和-NH2,在NaOH催化下发生分子之间的取代反应,一个分子的羧基脱去-OH,另一个分子的氨基脱去H原子,羟基与氢原子结合形成H2O,剩余部分结合在一起形成含两个环的有机物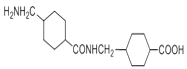 ,则该反应的化学反应方程式为:
,则该反应的化学反应方程式为: 。
。
(3)在上述反应中,①是加成反应,②是消去反应,③是加成反应,④是取代反应,⑤是酯的水解反应,也属于取代反应,⑥是还原反应,所以①~⑥中属于取代反应的是④⑤;
(4)E结构简式是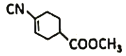 ,E中不含N原子的官能团名称为是酯基和碳碳双键;
,E中不含N原子的官能团名称为是酯基和碳碳双键;
(5)氨甲环酸(G)的结构简式是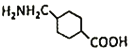 ,根据C原子价电子数目是4个,知G分子式为C8H15NO2;
,根据C原子价电子数目是4个,知G分子式为C8H15NO2;
(6)E是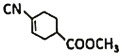 ,E的分子式是C9H11O2N,E的同分异构体符合下列条件:
,E的分子式是C9H11O2N,E的同分异构体符合下列条件:
a.E的不饱和度是5,E的同分异构体中含有苯环,苯环的不饱和度是4,说明含有一个双键;
b.分子含有硝基;c. 苯环上只有两个取代基,符合条件两个取代基可能为-NO2、-CH2CH2CH3;-NO2、-CH(CH3) 2;-CH3、-CH2CH2NO2;-CH3、-CHNO2CH3;-CH2NO2、-CH2CH3五种情况,两个取代基在苯环上的位置有邻、间、对三种位置,所以E的符合要求的同分异构体的种类是5×3=15种;
(7)以![]() 和为CH2=CHCOOCH2CH3原料制备
和为CH2=CHCOOCH2CH3原料制备 ,首先是
,首先是![]() 与Cl2按1:1发生1,2-加成反应生成
与Cl2按1:1发生1,2-加成反应生成 ,然后
,然后 与NaOH的乙醇溶液共热,发生消去反应生成
与NaOH的乙醇溶液共热,发生消去反应生成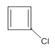 ,
, 再与CH2=CHCOOCH2CH3发生加成反应生成
再与CH2=CHCOOCH2CH3发生加成反应生成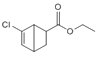 ,故合成路线为:
,故合成路线为: 。
。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案