题目内容
【题目】200℃时,11.6g二氧化碳和水蒸气的混合气体与足量的过氧化钠充分反应后固体质量增加了3.6g。下列说法中正确的是( )
A.二氧化碳与水蒸气的物质的量之比为4∶1
B.二氧化碳与水蒸气的质量之比为11∶8
C.反应中有0.25mol氧气放出
D.参加反应过氧化钠的的质量为19.5g
【答案】C
【解析】
200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,氧气的物质的量为:n(O2)=![]() =0.25mol,根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,以此解答。
=0.25mol,根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,以此解答。
A. 由分析可知n(混合气体)=0.5mol,设n(H2O)=xmol,n(CO2)=(0.5-x)mol,混合气体的总质量=18×x+44×(0.5-x)=11.6,解得x=0.4,则n(H2O)=0.4mol,n(CO2)=0.1mol,二氧化碳与水蒸气的物质的量之比为1∶4,故A错误;
B. 由A可知n(H2O)=0.4mol,n(CO2)=0.1mol,二氧化碳与水蒸气的质量之比为![]() =18:11,故B错误;
=18:11,故B错误;
C. 由分析可知,氧气的物质的量为:n(O2)=![]() =0.25mol,故C正确;
=0.25mol,故C正确;
D. 由反应方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知,参加反应的过氧化钠的质量=(0.1+0.4) mol×78 g·mol-1=39g,故 D 错误;
正确答案是C。

 孟建平名校考卷系列答案
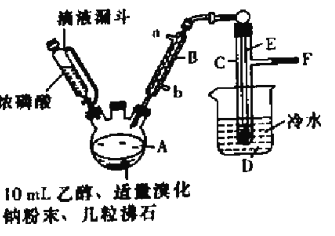
孟建平名校考卷系列答案【题目】实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置),反应原理为:H3PO4(浓)+NaBr![]() +NaH2PO4+HBr,CH3CH2OH+HBr
+NaH2PO4+HBr,CH3CH2OH+HBr![]() CH3CH2Br+H2O, 有关数据见下表:
CH3CH2Br+H2O, 有关数据见下表:
物质名称 | 乙醇 | 溴乙烷 | 溴 |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/gcm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中加入沸石的作用是______________________.
(2)仪器B的名称为____________,该仪器的进水口为_______(填“a”或“b”)口.
(3)实验中用滴液漏斗代替分液漏斗的优点为_________________
(4)制取氢溴酸时,为什么不能用浓H2SO4代替浓磷酸?_________(用化学方程式表示).
(5)将C中的馏出液转入锥形瓶中,边振荡边逐滴滴入浓H2SO4以除去水等杂质,滴加浓硫酸约1~2mL,使溶液明显分层,再用分液漏斗分去硫酸层,将经硫酸处理后的溴乙烷转入蒸馏瓶,水浴加热蒸馏,收集到35~40℃馏分约10.0g,从乙醇的角度考虑,本实验所得溴乙烷的产率是______(保留三位有效数字)
【题目】马日夫盐![]() 用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为
用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为![]() 及少量的FeO、
及少量的FeO、![]() 和
和![]() )为原料制备马日夫盐的主要工艺流程如图:
)为原料制备马日夫盐的主要工艺流程如图:
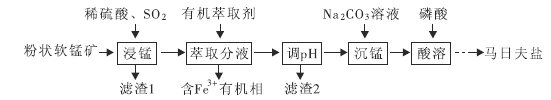
(1)“浸锰”过程中,FeO参与氧化还原反应的离子方程式为_______________。
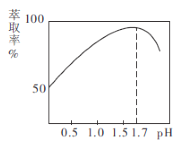
(2)![]() 的萃取率与溶液的pH的关系如图所示,当
的萃取率与溶液的pH的关系如图所示,当![]() 时,
时,![]() 的萃取率急剧下降的原因可能为_______________(用化学用语表示)。
的萃取率急剧下降的原因可能为_______________(用化学用语表示)。
(3)“调pH”的最大范围为________。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| l. 8 | 3.2 |
| 3.0 | 5.0 |
| 5.8 | 8.8 |
| 7.8 | 9.8 |
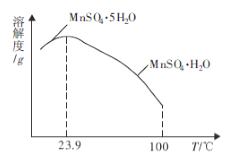
(4)如图为硫酸锰水合物的溶解度曲线,若要用“调pH”所得滤液制备![]() ,需要控制温度在80℃~90℃之间的原因是_____,采用水浴加热,经蒸发浓缩、_____(填操作名称)、用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥获得。
,需要控制温度在80℃~90℃之间的原因是_____,采用水浴加热,经蒸发浓缩、_____(填操作名称)、用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥获得。
(5)写出检验“沉锰”是否已完成的实验操作_________。
(6)常温下,马日夫盐溶液显________性(填“酸”或“碱”),理由是:____________。(写出计算过程并结合必要的文字说明。已知:![]() 的电离常数
的电离常数![]() ,
,![]() ,
,![]() )
)
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
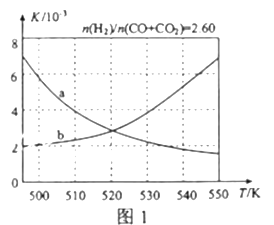
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
 .
.