��Ŀ����
���С������г��漰�ơ����仯���
��1����ҵ����Na2CO3��Һ����ˮ���е�CaSO4����Ӧ�����ӷ���ʽΪ___________________��ʵ�����У�Na2S��Һ���ڷ�������������ԭ��Ϊ___________________�������ӷ���ʽ��ʾ����
��2����ͼ�Ǵ������ϵͳ��ʾ��ͼ����������Ϊ����ʴ��ޣ�����Ϊ��أ���Ӧԭ��Ϊ�� �������ͨ�����ڴ��͵�ؼ�ѭ��������ѡ����Ĥֻ����������ͨ����
�������ͨ�����ڴ��͵�ؼ�ѭ��������ѡ����Ĥֻ����������ͨ����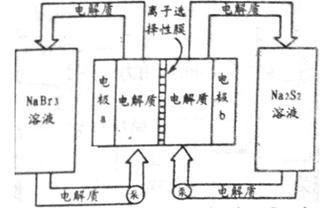
�����طŵ�ʱ�������Na+���ƶ�������_________���a��b����b��a�������缫a�ĵ缫��ӦʽΪ_______________�������ش��ڳ��״̬ʱ���缫b�ĵ缫��ӦʽΪ___________���øõ������Դ�����ö��Ե缫���200 mL 1 mol��L��1��AgNO3��Һ����������������2.16 gʱ��������Һ��pHΪ_________����������Һ����仯����
��3����ҵ�ϣ���Na2SO3��Һ��Ϊ����Һ�����������е�SO2������SO2�����У���ҺpH�� ��ϵ���±���
��ϵ���±���
 | 91��9 | 1��1 | 9��91 |
| pH��25�棩 | 8.2 | 7.2 | 6.2 |
�����ϱ��жϣ�NaHSO3��Һ��________�ԣ���ƽ��ԭ�����ͣ�__________________��
�ڵ���Һ������ʱ����Һ������Ũ�ȵĴ�С��ϵΪ_____________________________��
��1��CaSO4��s��+CO32-��aq��=CaCO3��s��+SO42-��aq��
2S2-+O2+2H2O=S��+4OH-
��2��b��a Br3-+2e-=3Br? S42- + 2e-=2S22- 1
��3������ ��HSO3-��Һ�д�����������ƽ��HSO3-+ H2O H2SO3+OH-��HSO3-
H2SO3+OH-��HSO3- SO32-+H+�������Ե���Ϊ��������ҺΪ���ԡ�
SO32-+H+�������Ե���Ϊ��������ҺΪ���ԡ�
�� C(Na+)��C(HSO3-)��C(SO32-)��C(OH-)=C(H+)
���������������1���÷�ӦΪ������ת����CaSO4����ˮ�����ӷ���ʽ��Ҫд��ѧʽ��
CaSO4��s��+CO32-��aq��=CaCO3��s��+SO42-��aq������д״̬Ҳ���ԣ�2S2-+O2+2H2O=S��+4OH-
(2)�����ܷ�Ӧ����ʽ���ŵ�ʱ�Ҳ�ĵ���ʴ�����Na2S2��ΪNa2S4��SԪ�ػ��ϼ۽��͵õ����ӣ��ô���Ϊԭ��ص�������Na+��ü��ƶ���a��������NaBr3�õ����ӱ�ΪNaBr����ⷴӦʽΪBr3-+2e-=3Br?�����ʱb��������Na2S4�õ����ӱ�ΪNa2S2���缫��ӦʽΪS42- + 2e-=2S22-��
����õ������ʵ���Ϊn(Ag)=2.16��108=0.02mol n(e-)=0.02mol
����Һ��OH-�ŵ磬n(H+)=n(OH-)=n(e-)=0.02mol��c(H+)=0.02��0.2=0.1mol/L pH=1
(3)�ɱ��е��������ݿ�֪����Һ��HSO3-����ʱ����Һ�����ԣ�����SO32-��HSO3-ˮ��ʼ��ԣ���ֻ����HSO3-����Һ���Ե���Ϊ����Һ�����ԣ���HSO3-��Һ�д�����������ƽ��HSO3-+ H2O H2SO3+OH-��HSO3-
H2SO3+OH-��HSO3- SO32-+H+�������Ե���Ϊ��������ҺΪ���ԡ�
SO32-+H+�������Ե���Ϊ��������ҺΪ���ԡ�
����Һ��1��1��ϳʼ��ԣ�������������HSO3-��Һ����ת��Ϊ���ԣ�NaHSO3������Na2SO3������
C(Na+)��C(HSO3-)��C(SO32-)��C(OH-)=C(H+)
���㣺���黯ѧ��Ӧԭ���е绯ѧ����Һ������Ũ�ȵıȽϡ�������ת�����й����⡣

ijѧϰС����̽��CaSO4����ת��ΪCaCO3�������Ӷ������ȥ�Ŀ����ԣ�����������ϣ�(�������ݺ�ʵ���ָ��25���²ⶨ)
| ���ܵ���� | CaCO3 | CaSO4 |
| Ksp(mol2��L��2) | 3��10��9 | 9��10��6 |
ʵ�鲽�����£�
����100 mL 0.1 mol��L��1��CaCl2��Һ�м���100 mL 0.1 mol��L��1��Na2SO4��Һ�������а�ɫ�������ɡ�
������������Һ�м������Na2CO3 3 g�����裬���ã���������ȥ�ϲ���Һ��
���ټ�������ˮ���裬���ã�����������ȥ�ϲ���Һ��
��������м������������ᡣ
��1���������������Һ��[Ca2��]��________ mol��L��1
��2��д���ڢڲ�������Ӧ�����ӷ���ʽ��________________________________.
��3����Ƶڢ۲���Ŀ����________________________________________________��
��4���ڢܲ���������������Ϊ�� ��
�����£���ijһԪ��HA��NaOH��Һ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH�����±���
| ʵ���� | HA���ʵ���Ũ��(mol��L-1) | NaOH���ʵ���Ũ��(mol��L-1) | �����Һ��pH |
| �� | 0.1 | 0.1 | pH��9 |
| �� | c | 0.2 | pH��7 |
| �� | 0.2 | 0.1 | pH��7 |
��ش�
��1���Ӣ������������ HA��ǿ�ỹ������ ��
��2���������������c 0.2 (ѡ�>������<���� ������)�����Һ������Ũ��c(A��) __c(Na��)
(ѡ�>������<���� ������)��
��3�� �Ӣ���ʵ����������˵��HA�ĵ���̶�______NaA��ˮ��̶� (ѡ�>������<���� ��=��)���û����Һ������Ũ���ɴ�С��˳���� ��
��4������ʵ�����û����Һ����ˮ�������c(OH��)�� mol��L��1��
д���û����Һ��������ʽ�ľ�ȷ���(���������Ƽ���)��
c(Na+)��c(A��)�� mol��L��1�� c(OH��)��c(HA)�� mol��L��1
��ҵ�������̿�Ϊԭ�ϣ������ս������е�SO2�Ʊ�MnSO4��H2O���������£�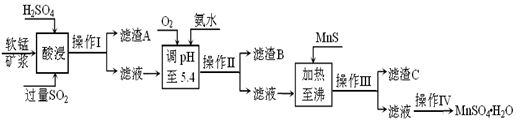
ij���̿����Ҫ�ɷ�ΪMnO2��������Si(16.27%)��Fe(5.86%)��Al(3.42%)��Zn(2.68%)��Cu��0.86%����Ԫ�صĻ����������̷�����Ӧ��MemOn+H+��Me��2n/m��++H2O��Me��ʾFe�� Al�� Zn�� Cu�ȡ�25��ʱ����������������������������ʽ��ȫ����ʱ��Һ��pH���±���
| ������ | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ��-0.42 | ��2.5 | ��7 | ��7 |
�ش��������⣺
��1�����ʱSO2��MnO2��ԭΪMnSO4�������ӷ���ʽΪ ���� ��
���ʱSO2����������pH���¶ȵĹ�ϵ����ͼ��Ϊ���SO2�������ʣ�������˵��������������������� ������
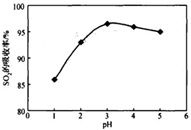
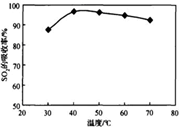
ͼ1�� SO2���������� pHֵ�Ĺ�ϵ �� ͼ2�� SO2�����������¶ȵĹ�ϵ
��2������B����Ҫ�ɷ��� ���� ��
��3������MnS��Ŀ���� �� ������������ ��
��4������IV�IJ���Ϊ���������������������������������ˡ�ϴ�ӡ����
��5��MnO2����������֮һ����ʯīΪ�缫���ڲ��Ͻ�������£�����ữ��MnSO4��Һ�������ĵ缫��ӦʽΪ�������� ������������������
��6����֪��������Ũ��С��1.0��10��5mol/Lʱ��Ϊ�Ѿ���ȫ���������ݱ������ݣ�����25��ʱZn(OH)2�ܶȻ�KspΪ �����������̣�������������λ��Ч���֣���
������ˮ������ҵ��ɰ�ǡ���֬��Ư����ɱ�������У���������(NaClO2)��������Ҫ�����á���ͼ�������������ƵĹ�������ͼ��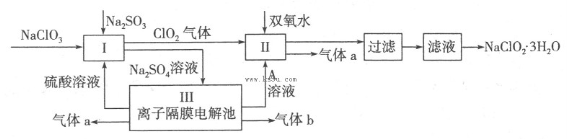
��֪����NaClO2���ܽ�����¶����߶������ʵ������¿ɽᾧ����
NaClO2��3H2O��
�ڳ����£�Ksp(FeS)=6��3��10-18��Ksp(CuS)=6��3��10-28��Ksp(PbS)=2��4 ��10-28
��1����ӦI�з�����Ӧ�����ӷ���ʽΪ ��
��2������Һ�еõ�NaClO2��3H2O������������������ (��д���)��
a������ b������Ũ�� c������ d����ȴ�ᾧ e������
��3��ӡȾ��ҵ������������(NaClO2)Ư��֯�Ư��֯��ʱ���������õ���HClO2���±���25��ʱHClO2�����ֳ�������ĵ���ƽ�ⳣ����
| ���� | HClO2 | HF | H2CO3 | H2S |
| Ka��mol��L-1 | 1��10-2 | 6.3��10-4 | K1=4.30��10-7 K2=5.60��10-11 | K1=9.1��10-8 K2=l.1��10-12 |
��Na2S�dz��õij�������ij��ҵ��ˮ�к��е�Ũ�ȵ�Cu2+��Fe2+��Pb2+���ӣ��μ�Na2S��Һ�����������ij����� �������£������һ�����ӳ�����ȫʱ(������Ũ��Ϊ10-5mol��L-1)��ʱ��ϵ�е�S2-��Ũ��Ϊ ��
��4����װ������������a�ĵ缫��Ӧʽ ������������a�����Ϊ1��12L(��״��)����ת�Ƶ��ӵ����ʵ���Ϊ ��
ij�ռ���Һ�к�����������(�������ᷴӦ)�������к͵ζ��ⶨ��Ũ�ȡ�
��1���ζ������� ʽ�ζ���ʢװc mol/L�����Һ����ͼ��ʾij�εζ�ʱ50 mL�ζ�����ǰ��Һ���λ�á��뽫��ȥ�ı�������������۱��ո��У���ʱ�ζ�����Һ������ mL��
���±���4�ֳ���ָʾ���ı�ɫ��Χ��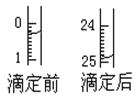
| ָʾ�� | ʯ�� | ���� | ���� | ��̪ |
| ��ɫ��Χ��pH�� | 5��0��8��0 | 3��1��4��4 | 4��4��6��2 | 8��2��10��0 |
��ʵ��Ӧѡ�� ��ָʾ����
���й����ݼ�¼���£�
| �ζ���� | ����Һ���(mL) | �����������Һ�����(mL) | ||
| �ζ�ǰ | �ζ��� | ���ĵ���� | ||
| 1 | V | 0��50 | 25��80 | 25��30 |
| 2 | V | | | |
| 3 | V | 6��00 | 31��35 | 25��35 |
��2�������������ݣ�д�������ռ���Ʒ�����ʵ���Ũ�ȵı���ʽ(���ػ���)c = ��
��3�������м��ּٶ�����������ۣ�(���Ӱ�족����ƫ�ߡ�����ƫ�͡�)
A�����ζ�ǰ������ˮ��ϴ��ƿ�����ʹ�ⶨ��� ��
B������ʱ�����ζ�ǰ���ӣ��ζ����ӣ����ʹ�ⶨ��� ��
C�����ڵζ������в�����������Һ������ƿ�⣬���ʹ�ⶨ��� ��
D���μ������ٶȹ��죬δ������տ�����Һ��ɫ������ֹͣ�ζ������ʹ�ⶨ��� ��
