题目内容
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作完成问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶完后,溶液中[H+]/[CH3COOH]的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)。(填“大于”、“小于”或“等于”,下同)
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中[Na+]、[CH3COO-]的大小关系为:[Na+]________[CH3COO-]。
(5)取25 mL的乙溶液,加入等体积pH=12的氨水,反应后溶液中的溶质为_________________。
(1)向右 减小 (2)小于 (3)大于 (4)小于 (5) NH4Cl、 NH3
解析试题分析:(1)醋酸是弱电解质,存在电离平衡CH3COOH CH3COO-+H+,稀释促进电离。所以取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡向右移动;另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),则溶液中CH3COO-浓度增大,抑制醋酸的电离。所以待固体溶完后,溶液中[H+]/[CH3COOH]的比值将减小。
CH3COO-+H+,稀释促进电离。所以取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡向右移动;另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),则溶液中CH3COO-浓度增大,抑制醋酸的电离。所以待固体溶完后,溶液中[H+]/[CH3COOH]的比值将减小。
(2)盐酸是强酸,完全电离,溶液中氢离子的物质的量不变。所以稀释100倍后盐酸的pH=2+2=4;醋酸是弱酸存在电离平衡,稀释促进电离,溶液中氢离子的物质的量增加,所以稀释100被后醋酸的2<pH<4。因此pH大小关系为:pH(甲)小于pH(乙)。
(3)醋酸是弱酸,存在电离平衡。因此在pH相等的条件下醋酸溶液的浓度大于盐酸溶液的浓度,所以各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)大于V(乙)。
(4)醋酸是弱酸,存在电离平衡。因此pH=2的醋酸溶液的浓度大于0.01mol/L,所以取25 mL的甲溶液,加入等体积pH=12的NaOH溶液后醋酸过量,溶液显酸性。则根据电荷守恒恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知,反应后溶液中[Na+]、[CH3COO-]的大小关系为:[Na+]小于[CH3COO-]。
(5)氨水是弱碱,因此pH=12的氨水溶液的浓度大于0.01mol/L,则取25 mL的乙溶液,加入等体积pH=12的氨水反应后,氨水过量,溶液显碱性。所以反应后溶液中的溶质为NH4Cl、NH3。
考点:考查弱电解质的电离、盐类水解、溶液酸碱性判断以及溶液中离子浓度大小比较

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1 NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2 mol·L-1 HCl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL 2 mol·L-1 NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程 。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因 。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是 。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是 。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是 。
③乙同学这样配制混合溶液的理由是 。
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:下表是不同温度下水的离子积数据:
| 温度 / ℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α________1×10-14(填“>”“<”或“=”)。
(2)25℃时,某HCl溶液中c(HCl)=1×10-4 mol·L-1,则该溶液的pH= ,此时c(H+)H2O= mol/L。加水稀释1000倍,则稀释后溶液中pH____ _7(填“>”“<”或“=”)。
(3)t2℃时,将pH=11的氢氧化钠钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=____________。
已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-) | B.c (CH3COO-)>c (Na +)>c (OH-)>c (H+) |
| C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-) | D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+) |
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(3)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(4)若该溶液由体积相等的醋酸和NaOH溶液混合而成,且恰好呈中性,则:
混合前c(CH3COOH) c(NaOH)(填“>”、“<”、或“=”,下同);
混合后溶液中c(Na+) c(CH3COO-)。
科研、生产中常涉及钠、硫及其化合物。
(1)工业上用Na2CO3溶液处理水垢中的CaSO4,反应的离子方程式为___________________;实验室中,Na2S溶液长期放置有硫析出,原因为___________________(用离子方程式表示)。
(2)下图是大型蓄电系统的示意图。左右两侧为电解质储罐,中央为电池,反应原理为: ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。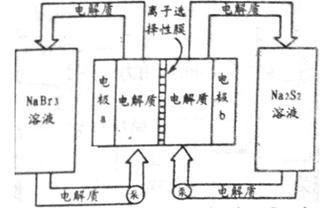
当蓄电池放电时,电池中Na+的移动方向是_________(填“a→b”或“b→a”),电极a的电极反应式为_______________;当蓄电池处于充电状态时,电极b的电极反应式为___________。用该电池做电源,采用惰性电极电解200 mL 1 mol·L-1的AgNO3溶液,当阴极质量增加2.16 g时,电解后溶液的pH为_________(不考虑溶液体积变化)。
(3)工业上,用Na2SO3溶液作为吸收液可吸收烟气中的SO2,吸收SO2过程中,溶液pH与 关系如下表:
关系如下表:
 | 91∶9 | 1∶1 | 9∶91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用平衡原理解释:__________________。
②当溶液呈中性时,溶液中离子浓度的大小关系为_____________________________。
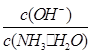 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。 H++SO42-。
H++SO42-。