题目内容
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4·H2O的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、 Al、 Zn、 Cu等。25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为 。
酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 。


图1: SO2的吸收率与 pH值的关系 图2: SO2的吸收率与温度的关系
(2)滤渣B的主要成分是 。
(3)加入MnS的目的是 。
(4)操作IV的步骤为 、 、过滤、洗涤、干燥。
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: 。
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为 (不需计算过程,计算结果保留两位有效数字)。
(17分)
(1) MnO2 +SO2= Mn2++SO42-(3分) pH为3左右、温度为40℃左右(2分)
(2)Fe(OH)3、Al(OH)3 (2分)
(3)除去Cu2+、Zn2+ (2分)
(4)蒸发浓缩 冷却结晶 (2分)
(5)Mn2+-2e-+2H2O = MnO2+ 4H+ (3分)
(6)1.0×10-17 (3分)
解析试题分析:(1)依题意,二氧化硫是还原剂,二氧化锰是氧化剂,硫酸根离子是氧化产物,锰离子是还原产物,根据元素化合价升降的最小公倍数、电荷和原子个数守恒法配平可得:MnO2 +SO2= Mn2++SO42-;读图可知,其它变量保持不变时,酸浸溶液pH为3左右时,二氧化硫的吸收率最大;其它变量保持不变时,酸浸溶液温度为40℃左右时,二氧化硫的吸收率最大;为了提高二氧化硫的吸收率,酸浸适宜的条件是pH为3左右、温度为40℃左右;(2)酸浸时,二氧化锰被二氧化硫氧化,所得硫酸锰溶于水,而铁的氧化物、铝的氧化物、锌的氧化物、铜的氧化物均溶于硫酸,只有硅的氧化物不溶于硫酸和水,则滤渣A的主要成分是二氧化硅;操作I是过滤,所得滤液主要含有Mn2+、Fe2+、Fe3+、Al3+、Cu2+、Zn2+、SO42-、H+,酸性条件下通入氧气的目的是除去Fe2+,使亚铁离子完全氧化为铁离子且消耗溶液中的氢离子,发生的反应为4Fe2++O2+4H+=4Fe3++2H2O,通入氨水中和过量的酸,NH3?H2O+H2SO4=(NH4)2SO4,使溶液的pH增大;读表中金属阳离子以氢氧化物形式完全沉淀时的pH可得,若调pH至5.4,使Fe3+、Al3+完全沉淀,生成Fe(OH)3、Al(OH)3,则滤渣B的主要成分是Fe(OH)3、Al(OH)3,操作II是过滤,所得滤液的pH约为5.4,主要含有Mn2+、Cu2+、Zn2+、SO42-、NH4+、H+;(3)读表格中金属阳离子以硫化物形式完全沉淀时的pH可得,向pH约为5.4的滤液中加入MnS,加热煮沸时,可以除去Cu2+、Zn2+,且引入Mn2+,既除去杂质又不引入新的杂质;(4)操作III是过滤,滤渣C的主要成分是CuS、ZnS;所得滤液的pH约为5.4,主要含有Mn2+、SO42-、NH4+、H+,从该溶液中分离出MnSO4?H2O的方法是结晶,主要步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;(5)阳极发生氧化反应,反应物中所含元素的化合价升高,由此推断阳极的主要反应物是Mn2+,主要产物是MnO2,根据化合价升高总数等于失去电子数,根据酸性溶液中用氢离子和水使左右电荷、原子守恒,可以书写并配平该阳极反应式:Mn2+-2e-+2H2O = MnO2+ 4H+;(6)氢氧化锌是难溶电解质,存在如下平衡: Zn(OH)2(s) Zn2++2OH-,由于表中氢氧化锌完全沉淀时溶液pH=8.0,25℃时Kw=1.0×10-14,则该溶液中c(H+)=1.0×10-8mol/L,c(OH-)=Kw/ c(H+)=10-6mol/L,由于此时溶液c(Zn2+)=1.0×10-5mol/L,则Ksp[Zn(OH)2(s)]= c(Zn2+)? c2(OH-)= 1.0×10-17,注意保留两位有效数字。
Zn2++2OH-,由于表中氢氧化锌完全沉淀时溶液pH=8.0,25℃时Kw=1.0×10-14,则该溶液中c(H+)=1.0×10-8mol/L,c(OH-)=Kw/ c(H+)=10-6mol/L,由于此时溶液c(Zn2+)=1.0×10-5mol/L,则Ksp[Zn(OH)2(s)]= c(Zn2+)? c2(OH-)= 1.0×10-17,注意保留两位有效数字。
考点:考查物质制备工艺流程,涉及二氧化硫的还原性、二氧化锰的氧化性、氧化还原反应、离子方程式、二氧化硫吸收率与酸浸溶液pH和温度的关系、滤渣B的主要成分、晶体制备的操作步骤、电解法制备二氧化锰的阳极反应式、氢氧化锌沉淀完全时溶液的pH与水的离子积的计算、氢氧化锌溶度积的计算等。

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科研、生产中常涉及钠、硫及其化合物。
(1)工业上用Na2CO3溶液处理水垢中的CaSO4,反应的离子方程式为___________________;实验室中,Na2S溶液长期放置有硫析出,原因为___________________(用离子方程式表示)。
(2)下图是大型蓄电系统的示意图。左右两侧为电解质储罐,中央为电池,反应原理为: ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。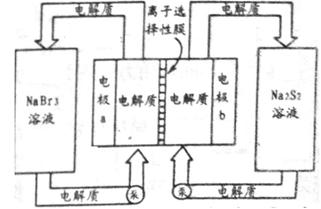
当蓄电池放电时,电池中Na+的移动方向是_________(填“a→b”或“b→a”),电极a的电极反应式为_______________;当蓄电池处于充电状态时,电极b的电极反应式为___________。用该电池做电源,采用惰性电极电解200 mL 1 mol·L-1的AgNO3溶液,当阴极质量增加2.16 g时,电解后溶液的pH为_________(不考虑溶液体积变化)。
(3)工业上,用Na2SO3溶液作为吸收液可吸收烟气中的SO2,吸收SO2过程中,溶液pH与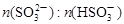 关系如下表:
关系如下表:
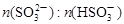 | 91∶9 | 1∶1 | 9∶91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用平衡原理解释:__________________。
②当溶液呈中性时,溶液中离子浓度的大小关系为_____________________________。
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐行业生产中排出大量的钡泥[主要含有BaCO3、 BaSO3、 Ba( FeO2)2等],某主要生产BaCO3、 BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下: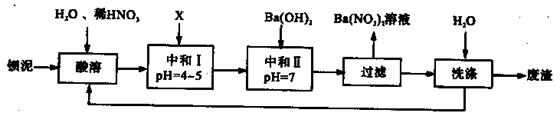
又已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③KSP(BaSO4)=1.lxl0-10, KSP(BaCO3)=5.1×10-9.
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理:______________ 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:
。
(3)该厂结合本厂实际,选用的X为 (填序号);
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
结合离子方程式简述原理 。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是 。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为 。
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 ,直到最后加入一滴盐酸后,溶液由 色变为 ,且 为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |

(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.20 | 20.22 | |
| 第二次 | 25.00 | 0.56 | 24.54 | |
| 第三次 | 25.00 | 0.42 | 20.40 | |
依据上表数据求得NaOH溶液的物质的量浓度为 。
 H++SO42-。
H++SO42-。 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH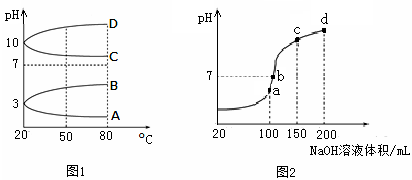
 ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH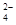 )-c(NH
)-c(NH
 Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
 Cu(OH) 2+2H+的平衡常数K=_______。
Cu(OH) 2+2H+的平衡常数K=_______。