题目内容
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况分析, HA是强酸还是弱酸 。
(2)②组情况表明,c 0.2 (选填“>”、“<”或 “=”)。混合液中离子浓度c(A-) __c(Na+)
(选填“>”、“<”或 “=”)。
(3) 从③组实验结果分析,说明HA的电离程度______NaA的水解程度 (选填“>”、“<”或 “=”),该混合溶液中离子浓度由大到小的顺序是 。
(4)①组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
写出该混合溶液中下列算式的精确结果(不能作近似计算)。
c(Na+)-c(A-)= mol·L-1; c(OH-)-c(HA)= mol·L-1
(1)HA是弱酸;(1分)
(2) >(1分); c(A-)=c(Na+)(1分)
(3)>(1分); c(A-) >c(Na+) >c(H+)> c(OH-)(1分)
(4)10 -5(1分); 10 -5-10 -9(2分);10 -9(2分)
解析试题分析:(l)根据表中数据可知,当二者恰好反应时,溶液显碱性。这说明生成的NaA水解,溶液显碱性,由此可知 HA是弱酸。
(2)HA是弱电解质,如果二者恰好反应,溶液显示碱性。若要使pH=7,则加入的HA应该过量,故应该大c>0.2mol/L。pH=7,氢离子等于氢氧根浓度,根据电荷守恒c(Na+)+c(H+)= c(A-)+ c(OH-),由此c(A-)=c(Na+)。
(3)根据③的结果可知,反应后HA是过量的,由此混合液是由等物质的量浓度的HA和NaA组成的。溶液显酸性,说明A-的水解程度小于HA的电离程度,所以溶液中离子浓度大小关系为c(A-) >c(Na+) >c(H+)> c(OH-)。
(4)强碱弱酸盐溶液中,弱酸根结合水电离的氢离子,溶液显示碱性,溶液中的氢氧根就是水电离出来的,所以①组实验所得混合溶液中由水电离出的c(OH-)=10-14÷10-9=10-5mol/L;根据电荷守恒c(Na+)+c(H+)= c(A-)+ c(OH-),故c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9)mol/L;根据物料守恒可知c(Na+)=c(HA)+c(A-),带人电荷守恒c(Na+)+c(H+)= c(A-)+ c(OH-),得c(OH-)-c(HA)=c(H+)=10-9mol/L。
考点:考查弱电解质在水溶液中的电离平衡;盐类水解的原理;离子浓度大小的比较

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:下表是不同温度下水的离子积数据:
| 温度 / ℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α________1×10-14(填“>”“<”或“=”)。
(2)25℃时,某HCl溶液中c(HCl)=1×10-4 mol·L-1,则该溶液的pH= ,此时c(H+)H2O= mol/L。加水稀释1000倍,则稀释后溶液中pH____ _7(填“>”“<”或“=”)。
(3)t2℃时,将pH=11的氢氧化钠钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=____________。
(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示95 ℃时水的电离达平衡时的离子浓度。则95℃时0.1 mol·L-1的NaOH溶液中,由水电离出的 c(H+)= mol·L-1,Kw(25 ℃) Kw(95℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl 固体,对水的电离平衡的影响是 (填“促进”、“抑制”或“不影响”)。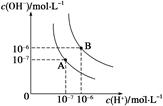
(2)25℃时,在0.1L 0.2 mol·L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= ,电离度为 。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量(已知如表数据)。向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
| 化学式 | 电离平衡常数(25 ℃) |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
科研、生产中常涉及钠、硫及其化合物。
(1)工业上用Na2CO3溶液处理水垢中的CaSO4,反应的离子方程式为___________________;实验室中,Na2S溶液长期放置有硫析出,原因为___________________(用离子方程式表示)。
(2)下图是大型蓄电系统的示意图。左右两侧为电解质储罐,中央为电池,反应原理为: ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。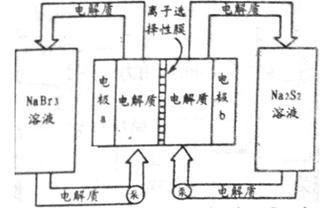
当蓄电池放电时,电池中Na+的移动方向是_________(填“a→b”或“b→a”),电极a的电极反应式为_______________;当蓄电池处于充电状态时,电极b的电极反应式为___________。用该电池做电源,采用惰性电极电解200 mL 1 mol·L-1的AgNO3溶液,当阴极质量增加2.16 g时,电解后溶液的pH为_________(不考虑溶液体积变化)。
(3)工业上,用Na2SO3溶液作为吸收液可吸收烟气中的SO2,吸收SO2过程中,溶液pH与 关系如下表:
关系如下表:
 | 91∶9 | 1∶1 | 9∶91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用平衡原理解释:__________________。
②当溶液呈中性时,溶液中离子浓度的大小关系为_____________________________。
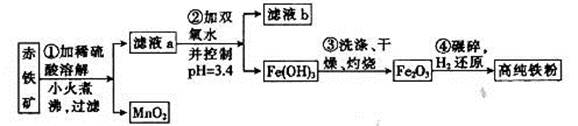
 Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
 Cu(OH) 2+2H+的平衡常数K=_______。
Cu(OH) 2+2H+的平衡常数K=_______。