题目内容
9.将22.4L(标准状况)乙烯和乙烷的混合气体通入足量的溴水中,充分反应后,溴水的质量增加了16.8克.求原混合物中乙烯和乙烷的物质的量之比和质量比.分析 标况下22.4L混合气体的物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,乙烷性质较稳定,和溴水不反应,乙烯和溴水发生加成反应,所以混合气体通入溴水中溶液质量增加的量是乙烯质量,则乙烯质量为16.8g,n(C2H4)=$\frac{16.8g}{28g/mol}$=0.6mol,则n(C2H6)=(1-0.6)mol=0.4mol,m(C2H6)=0.4mol×30g/mol=12g,据此分析解答.
解答 解:标况下22.4L混合气体的物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,乙烷性质较稳定,和溴水不反应,乙烯和溴水发生加成反应,所以混合气体通入溴水中溶液质量增加的量是乙烯质量,则乙烯质量为16.8g,n(C2H4)=$\frac{16.8g}{28g/mol}$=0.6mol,则n(C2H6)=(1-0.6)mol=0.4mol,m(C2H6)=0.4mol×30g/mol=12g,
所以n(C2H4):n(C2H6)=0.6mol:0.4mol=3:2;
m(C2H4):m(C2H6)=16.8g:12g=7:5,
答:原混合物中乙烯和乙烷的物质的量之比和质量比分别是3:2、7:5.
点评 本题考查混合物的有关计算,为高频考点,熟悉物质的量公式中各个物理量的关系是解本题关键,侧重考查学生计算能力,题目难度不大.

练习册系列答案
相关题目
19.下列说法不正确的是( )
| A. | CS2 与CO2均为直线形非极性分子 | |
| B. | 熔点:SiCl4<MgCl2<SiO2 | |
| C. | 水加热到很高的温度都难以分解,是因为水中含有氢键 | |
| D. | 断裂化学键的过程不一定发生化学变化 |
17.2015年6月5日世界环境日中国的主题定为“践行绿色生活”,旨在增强全民节约环保的意识,下列措施有利于节能减排、保护环境的是①加快化石燃料的开采与使用;②实施清洁生产;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料.( )
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | ②④⑤ |
14.化学在生产和生活中有着重要的应用.下列说法正确的是( )
| A. | 漂白粉和明矾常用于水处理,这两者净水原理相同 | |
| B. | “地沟油”经过加工处理可用来制肥皂,可实现厨余废物合理利用 | |
| C. | 碳酸钠在医疗上是治疗胃酸过多的一种药剂 | |
| D. | 高炉炼铁的常用FeS2作为炼铁的原料 |
1.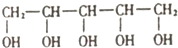 木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )
木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )
 木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )
木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )| A. | 木糖醇易溶于水,溶解过程的△H>0 | |
| B. | 一定条件下,木糖醇能与HCl反应,也能与醋酸反应,属于同一反应类型 | |
| C. | 木糖醇是一种单糖,不能发生水解反应 | |
| D. | 1mol木糖醇与足量的钠反应最多可产生2.5molH2 |
18.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,下列说法不正确的是( )
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素最高价氧化物对应水化物的酸性一定强于Y | |
| C. | X与Y元素形成的两种常见化合物分别溶于水后溶液PH<7 | |
| D. | Z元素单质在化学反应中只表现氧化性 |
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
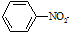 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$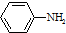 (苯胺,易被氧化)
(苯胺,易被氧化)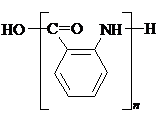 或
或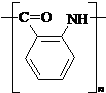 ;
;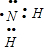 ;
;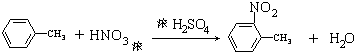 ;
;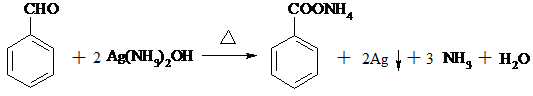 ;
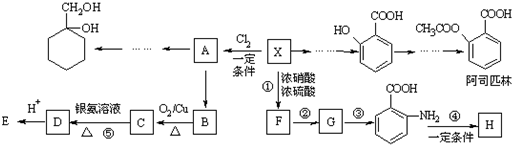
;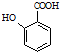 有多种同分异构体,写出2种含有1个醛基和2个羟基的芳香族化合物的结构简式:
有多种同分异构体,写出2种含有1个醛基和2个羟基的芳香族化合物的结构简式: ;
;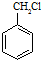 和其他无机物合成
和其他无机物合成 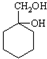 最合理的方案(不超过4步).
最合理的方案(不超过4步).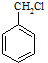 $→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$
$→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$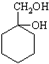
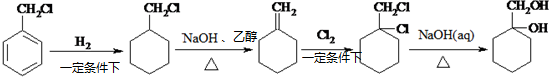 .
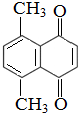
.
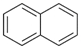 )的衍生物,且与A互为同分异构体.
)的衍生物,且与A互为同分异构体.