题目内容
9.已知有机物A的结构简式如图所示,回答下列问题: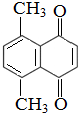
(1)A的分子式为C12H10O2,1mol A最多可以与7mol H2 反应,反应后的物质与相同碳原子数的烷烃比较,氢原子数相差4个;
(2)有机物B是萘(
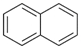 )的衍生物,且与A互为同分异构体.
)的衍生物,且与A互为同分异构体.若B分子含有与萘环相连的-CHO,则处萘环外,余下的取代基可能的结构简式为-CH2OH、-OCH3、-OH和CH3.
分析 (1)根据A的结构简式可知其分子式为C12H10O2;A分子中含有1个苯环(苯环与氢气按照1:3反应)、1个碳碳双键、2个碳氧双键,据此计算1molA与氢气发生加成反应最多消耗氢气的物质的量;A与氢气加成后的产物中含有两个环状结构,每个环比烷烃少2个H原子,据此判断A加氢后的产物比同碳原子数的烷烃少的H原子数;
(2)A、B互为同分异构体,将A分子的两个环变为萘环( ),相当于环内增加1个双键,则侧链少1个双键,只剩下1个双键;则推出B的分子结构含1个萘环,侧链有2个C原子、两个O原子和若干H原子,且有1个双键;若B分子含有与萘环相连的-CHO,则除萘环外,侧链含有1个C原子、1个O原子,若干H原子,只有单键,据此推断其组成的取代基的结构简式.
),相当于环内增加1个双键,则侧链少1个双键,只剩下1个双键;则推出B的分子结构含1个萘环,侧链有2个C原子、两个O原子和若干H原子,且有1个双键;若B分子含有与萘环相连的-CHO,则除萘环外,侧链含有1个C原子、1个O原子,若干H原子,只有单键,据此推断其组成的取代基的结构简式.
解答 解:(1)根据A的结构简式可知,A分子中含有12个C、10个H和2个O原子,其分子式为:C12H10O2;A分子中含有1个苯环(苯环与氢气按照1:3反应)、1个碳碳双键、2个碳氧双键,1molA与氢气发生加成反应,最多消耗氢气的物质的量为:(4+1+2)mol=7mol;A与氢气加成后的产物中含有两个环状结构,每个环比烷烃少2个H原子,则A加氢后的产物比同碳原子数的烷烃少4个H原子,
故答案为:C12H10O2;7;4;
(2)A、B互为同分异构体,将A分子的两个环变为萘环( ),相当于环内增加1个双键,则侧链少1个双键,只剩下1个双键;则推出B的分子结构含1个萘环,侧链有2个C原子、两个O原子和若干H原子,且有1个双键,
),相当于环内增加1个双键,则侧链少1个双键,只剩下1个双键;则推出B的分子结构含1个萘环,侧链有2个C原子、两个O原子和若干H原子,且有1个双键,
若B分子含有与萘环相连的-CHO,则除萘环外,侧链含有1个C原子、1个O原子,若干H原子,只有单键,则可组合成的结构由3种:-CH2OH、-OCH3、-OH和CH3,
故答案为:-CH2OH、-OCH3、-OH和CH3.
点评 本题考查了有机物结构与性质、同分异构体的求算,题目难度中等,注意掌握常见有机物结构与性质,明确同分异构体的能够及书写原则,试题培养了学生的分析能力及逻辑推理能力.

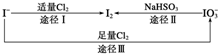 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:(1)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示.
下列说法中不正确的是C
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O═2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D.途径Ⅱ中若生成1mol I2,则反应中转移的电子数为10NA
(2)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+I-(aq)═I3-(aq) …①
I2(aq)+2I-(aq)═I42-(aq) …②
则反应②的平衡常数表达式,K=$\frac{c({I}_{4}^{2-})}{c({I}_{2}){c}^{2}({I}^{-})}$.
I2的起始浓度均为0.1mol•L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
| KI起始浓度/mol•L-1 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 |
| I3-% | 88.98 | 88.04 | 85.28 | 82.26 | 79.23 |
| I42-% | 4.38 | 8.67 | 12.60 | 16.21 | 19.53 |
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉作指示剂作滴定指示荆,滴定终点的现象是溶液由蓝色变为无色且半分钟内不恢复为蓝色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2..
③该试样中CuCl2•2H2O的质量百分数为95%.
| A. | 酸碱中和反应属放热反应 | |
| B. | 化学变化中的能量变化主要由化学键变化引起的 | |
| C. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| D. | 相同条件下,1mol石墨转化为金刚石要吸收1.895kJ热量,说明金刚石比石墨稳定 |
 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
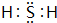 .
.(2)②、③、⑤元素的原子半径由大到小的顺序为Na>C>N.
(3)②、④、⑦元素的气态氢化物稳定性由强到弱的顺序是H2O>CH4>SiH4.
(4)有两种化合物A和B都由①④⑤⑧四种元素组成.若A与B在水溶液中能发生离子反应,则该反应的离子方程式为H++HSO3-=H2O+SO2↑.
(5)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.
| A. | 共价化合物:是否含有共价键 | |
| B. | 氧化还原反应:元素化合价是否变化 | |
| C. | 强弱电解质:溶液的导电能力大小 | |
| D. | 溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
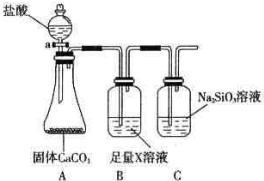
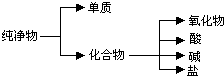 (1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)
(1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)