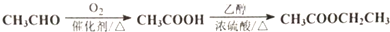题目内容
18.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,下列说法不正确的是( )| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素最高价氧化物对应水化物的酸性一定强于Y | |
| C. | X与Y元素形成的两种常见化合物分别溶于水后溶液PH<7 | |
| D. | Z元素单质在化学反应中只表现氧化性 |
分析 W、X、Y、Z四种短周期元素,W的气态氢化物可与其最高价含氧酸生成离子化合物,应是铵盐,则W是N元素,由元素在周期表中的位置可知,X为O元素、Y为S元素、Z为Cl元素,据此解答.
解答 解:W、X、Y、Z四种短周期元素,W的气态氢化物可与其最高价含氧酸生成离子化合物,应是铵盐,则W是N元素,由元素在周期表中的位置可知,X为O元素、Y为S元素、Z为Cl元素.
A.非金属O>S,Cl>S,则其氢化物中H2S最不稳定,故A正确;
B.非金属性Cl>S,氯元素的最高价含氧酸一定比Y的含氧酸酸性强,故B正确;
C.X与Y元素形成的两种常见化合物分别为SO2、SO3,溶于水分别得到亚硫酸、硫酸,溶液的PH<7,故C正确;
D.Cl2与水的反应生成HCl与HClO,硫酸既表现氧化性,也表现了还原性,故D错误;
故选D.
点评 本题考查位置结构性质关系、元素周期律等,难度不大,推断元素是解题的关键,注意整体把握元素周期表的结构,W是推断的突破口.

练习册系列答案
相关题目
8.下列说法不正确的是( )
| A. | 各种物质都储存有化学能 | |
| B. | 化学反应一定伴随着能量的变化 | |
| C. | 断开反应物中的化学键要释放出能量 | |
| D. | 化学反应中的能量变化,通常主要表现为热量变化 |
3.分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法.下列(2)中的物质并不能按照对应的分类标准与(1)中的物质归为一类的是( )
| 选项 | (1) | (2) | 分类标准 |
| A | 盐酸、漂白粉、水玻璃、双氧水 | 氨水 | 混合物 |
| B | CH3COOH,H2CO3、HClO、NH3•H2O | HF | 弱电解质 |
| C | 电解反应、盐的水解、煤的干馏、石油裂化 | 钢铁生锈 | 化学变化 |
| D | CO2、SO3、P2O5、SiO2 | Al2O3 | 酸性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
17.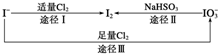 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:
(1)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示.
下列说法中不正确的是C
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O═2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D.途径Ⅱ中若生成1mol I2,则反应中转移的电子数为10NA
(2)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+I-(aq)═I3-(aq) …①
I2(aq)+2I-(aq)═I42-(aq) …②
则反应②的平衡常数表达式,K=$\frac{c({I}_{4}^{2-})}{c({I}_{2}){c}^{2}({I}^{-})}$.
I2的起始浓度均为0.1mol•L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
根据表中数据,可得出的两条结论是①条件相同时,I3-离子的物质的量分数组成始终占绝对优势(或I3-含量高,I42-含量低)、②?随I-离子浓度的增加,I3-离子的物质的量分数降低,I42-离子的物质的量分数增加.;
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉作指示剂作滴定指示荆,滴定终点的现象是溶液由蓝色变为无色且半分钟内不恢复为蓝色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2..
③该试样中CuCl2•2H2O的质量百分数为95%.
 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:(1)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示.
下列说法中不正确的是C
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O═2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D.途径Ⅱ中若生成1mol I2,则反应中转移的电子数为10NA
(2)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+I-(aq)═I3-(aq) …①
I2(aq)+2I-(aq)═I42-(aq) …②
则反应②的平衡常数表达式,K=$\frac{c({I}_{4}^{2-})}{c({I}_{2}){c}^{2}({I}^{-})}$.
I2的起始浓度均为0.1mol•L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
| KI起始浓度/mol•L-1 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 |
| I3-% | 88.98 | 88.04 | 85.28 | 82.26 | 79.23 |
| I42-% | 4.38 | 8.67 | 12.60 | 16.21 | 19.53 |
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉作指示剂作滴定指示荆,滴定终点的现象是溶液由蓝色变为无色且半分钟内不恢复为蓝色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2..
③该试样中CuCl2•2H2O的质量百分数为95%.
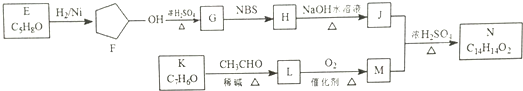
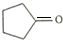 .
. .
.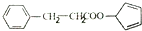 ,请再写出三种五元环上不是含一个双键的同分异构体:
,请再写出三种五元环上不是含一个双键的同分异构体: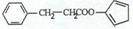 、
、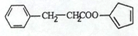 、
、 .
.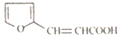 )是一种医治血吸虫病的药呋喃丙胺的原料.请以
)是一种医治血吸虫病的药呋喃丙胺的原料.请以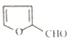 、CH3CH2OH为有机原料合成呋喃.(无机试剂及溶剂任选)
、CH3CH2OH为有机原料合成呋喃.(无机试剂及溶剂任选)