题目内容
19.下列说法不正确的是( )| A. | CS2 与CO2均为直线形非极性分子 | |
| B. | 熔点:SiCl4<MgCl2<SiO2 | |
| C. | 水加热到很高的温度都难以分解,是因为水中含有氢键 | |
| D. | 断裂化学键的过程不一定发生化学变化 |
分析 A.分子结构对称,正负电荷中心重叠的分子为非极性分子;
B.不同晶体熔点的一般规律:分子晶体<离子晶体<原子晶体;
C.分子中共价键键能越大,分子越稳定;
D.电解质溶于水发生电离时化学键会断裂.
解答 解:A.CS2 与CO2均为直线形结构,分子结构对称,正负电荷中心重叠的分子为非极性分子,故A正确;
B.SiCl4属于分子晶体,MgCl2属于离子晶体,SiO2属于原子晶体,则熔点:SiCl4<MgCl2<SiO2,故B正确;
C.分子中共价键键能越大,分子越稳定,水加热到很高的温度都难以分解,是因为水分子中H-O的键能很大,难断裂,氢键决定物理性质,与分子的稳定性无关,故C错误;
D.电解质溶于水发生电离时化学键会断裂,如氯化钠溶于水时离子键会断裂,但是没有新物质生成属于物理变化,故D正确.
故选C.
点评 本题考查物质结构与性质知识,题目涉及分子极性的判断、不同晶体熔点的比较、共价键与分子稳定性的关系、氢键和化学键,题目考查的知识点较多,注意基础知识的积累,难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
9.下列实验装置能达到实验目的是( )
| A. | 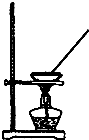 如图所示装置获得碳酸氢钠固体 | B. | 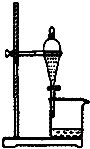 如图所示装置分离乙酸和乙酸乙酯 | ||
| C. | 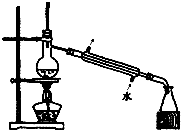 如图所示装置制取少量蒸馏水 | D. | 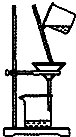 如图所示装置提纯氢氧化铁胶体 |
10.下列有机化合物的分类不正确的是( )
| A. | 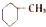 苯的同系物 | B. | 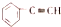 芳香烃 | C. |  卤代烃 | D. |  酯 |
7.下列反应中,能够说明乙烯分子具有不饱和键的是( )
| A. | 加成反应 | B. | 取代反应 | C. | 燃烧 | D. | 氧化反应 |
14.下列电子式书写正确的是( )
| A. | NaCl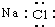 | B. | OH-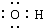 | C. | HCl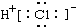 | D. | Na2O2 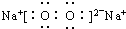 |
11.下列说法不正确的是( )
| A. | 光催化还原水制氢气比电解水制取氢更节能环保、更经济 | |
| B. | 氯气加压液化可用钢瓶贮存运输 | |
| C. | 向汽油中添加甲醇后,可减少汽车尾气的排放 | |
| D. | 明矾既可做净水剂也可作消毒剂 |
8.下列说法不正确的是( )
| A. | 各种物质都储存有化学能 | |
| B. | 化学反应一定伴随着能量的变化 | |
| C. | 断开反应物中的化学键要释放出能量 | |
| D. | 化学反应中的能量变化,通常主要表现为热量变化 |