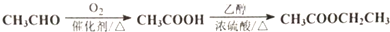题目内容
14.化学在生产和生活中有着重要的应用.下列说法正确的是( )| A. | 漂白粉和明矾常用于水处理,这两者净水原理相同 | |
| B. | “地沟油”经过加工处理可用来制肥皂,可实现厨余废物合理利用 | |
| C. | 碳酸钠在医疗上是治疗胃酸过多的一种药剂 | |
| D. | 高炉炼铁的常用FeS2作为炼铁的原料 |
分析 A.明矾没有强氧化性,漂白粉有强氧化性;
B.“地沟油”的主要成分是高级脂肪酸甘油酯,油酯在碱性条件下发生皂化反应,生成肥皂;
C.碳酸氢钠为治疗胃酸过多的药剂;
D.FeS2会对大气造成污染.
解答 解:A.明矾中的铝离子在水中水解生成氢氧化铝胶体,能吸附悬浮颗粒,而净水,漂白粉有强氧化性,能杀死水中的细菌和病毒,所以二者作用原理不同,故A错误;B.“地沟油”的主要成分是高级脂肪酸甘油酯,高级脂肪酸甘油酯在碱性条件下发生皂化反应,生成肥皂,故B正确;
C.常用碳酸氢钠作为治疗胃酸过多的药剂,碳酸钠碱性太强,故C错误;
D.由于FeS2会对大气造成污染,故不是高炉炼铁的原料,常用氧化铁作原料,故D错误,
故选B.
点评 本题主要考查的是明矾净水原理、碳酸氢钠的用途、高炉炼铁原理等,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.如表是元素周期表的一部分,针对表中的①-⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填元素符号).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: .
.
(3)最高价氧化物是两性氧化物的元素是Al(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程 .
.
| 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)最高价氧化物是两性氧化物的元素是Al(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程
 .
.
2.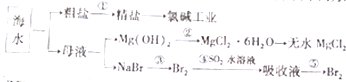 海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )
海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )
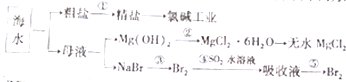 海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )
海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )| A. | 大量的氮、磷废水排入海洋,易引起赤潮 | |
| B. | 空气吹出法是用于工业规模海水提溴的常用方法 | |
| C. | 在过程③中溴元素被氧化,而在过程④中溴元素被还原 | |
| D. | 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+、等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
19.下列说法不正确的是( )
| A. | 有机化学实验中需要用温度计的有石油分馏、硝基苯的制备和乙烯的制取 | |
| B. | 用溴水可以鉴别苯酚溶液、甲苯、乙醇和苯乙烯 | |
| C. | 用酒精可以处理粘在皮肤上的苯酚或苯酚醛树脂制备实验后的试管 | |
| D. | 取适量卤代烃水解后产物,直接滴加AgNO3溶液以确定卤原子种类 |
3.分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法.下列(2)中的物质并不能按照对应的分类标准与(1)中的物质归为一类的是( )
| 选项 | (1) | (2) | 分类标准 |
| A | 盐酸、漂白粉、水玻璃、双氧水 | 氨水 | 混合物 |
| B | CH3COOH,H2CO3、HClO、NH3•H2O | HF | 弱电解质 |
| C | 电解反应、盐的水解、煤的干馏、石油裂化 | 钢铁生锈 | 化学变化 |
| D | CO2、SO3、P2O5、SiO2 | Al2O3 | 酸性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
14.下列说法中,错误的是( )
| A. | 酸碱中和反应属放热反应 | |
| B. | 化学变化中的能量变化主要由化学键变化引起的 | |
| C. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| D. | 相同条件下,1mol石墨转化为金刚石要吸收1.895kJ热量,说明金刚石比石墨稳定 |
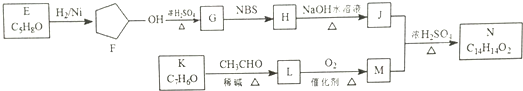
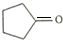 .
. .
.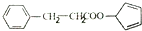 ,请再写出三种五元环上不是含一个双键的同分异构体:
,请再写出三种五元环上不是含一个双键的同分异构体: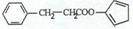 、
、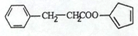 、
、 .
.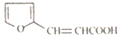 )是一种医治血吸虫病的药呋喃丙胺的原料.请以
)是一种医治血吸虫病的药呋喃丙胺的原料.请以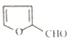 、CH3CH2OH为有机原料合成呋喃.(无机试剂及溶剂任选)
、CH3CH2OH为有机原料合成呋喃.(无机试剂及溶剂任选)