题目内容
20.某元素A的最高正化合价与负化合价的代数和等于4,它的最高价氧化物中氧占60%,且A的原子中具有相同的质子数和中子数,则A的元素符号为( )| A. | C | B. | Cl | C. | S | D. | P |
分析 某元素A的最高正化合价与负化合价的代数和等于4,则A的最高正化合价为+6,它的最高价氧化物为AO3,结合氧元素质量分数计算A的相对原子质量,再计算质子数,进而确定元素.
解答 解:某元素A的最高正化合价与负化合价的代数和等于4,则A的最高正化合价为+6,它的最高价氧化物为AO3,设A的相对原子质量为a,则$\frac{16×3}{a+16×3}$×100%=60%,解得a=32,A的原子中具有相同的质子数和中子数,则其质子数为$\frac{32}{2}$=16,故X为S元素,故选C.
点评 本题考查结构性质位置关系应用,属于计算型推断,关键是书写最高价氧化物的化学式,难度不大.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
11.下列是几种原子的基态电子排布,电负性最大的原子是( )
| A. | 1s22s22p4 | B. | 1s22s22p63s23p3 | ||
| C. | 1s22s22p3 | D. | 1s22s22p63s23p64s2 |
8.将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为2.24L.将反应后的固体残渣与过量的稀盐酸反应,又生成3.36L的CO2.(以上或以下气体体积均为标准状况时的体积),下列判断正确的是( )
| A. | 原固体混合物中NaHCO3的物质的量为0.2mol | |
| B. | 固体残渣的成分为NaOH和Na2CO3的混合物 | |
| C. | 原固体混合物中NaOH和NaHCO3的物质的量之比为2﹕5 | |
| D. | 原固体混合物中加入过量盐酸会放出5.6L气体 |
15.丁烷的一氯代物的同分异构体有多少种( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
5.某元素R原子最外层电子数为电子总数的$\frac{1}{3}$,该元素的氧化物可能是( )
| A. | R2O | B. | R2O2 | C. | RO2 | D. | R2O5 |
10.下列反应中反应类型不相同的是( )
| A. | 乙烯与水反应生成乙醇,乙炔与氢气反应 | |
| B. | 光照下,丙烷与氯气的反应;丙炔与溴的四氯化碳溶液反应 | |
| C. | 丙烯与酸性高锰酸钾溶液反应;丁烷燃烧 | |
| D. | 乙烯生成聚乙烯,乙炔生成聚乙炔 |
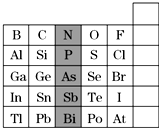 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分: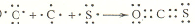 .
.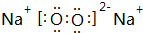 .
. ,空间构型直线型,属于非极性分子(填“极性”或“非极性”)
,空间构型直线型,属于非极性分子(填“极性”或“非极性”)