题目内容
10.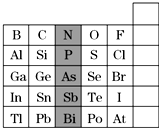 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分:(1)根据元素周期律,请你预测,H3AsO4、H3PO4的酸性强弱:H3AsO4<H3PO4(填“>”、“<”或“=”).
(2)元素甲是第三周期金属元素中原子半径最小的元素,该元素的离子与过量氨水反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
(3)周期表中有10多种人体所需的微量元素,其中有一种被誉为“生命元素”的主族元素R,对延长人类寿命起着重要作用.已知R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,则R元素的名称为C.
A.硫 B.砷 C.硒 D.硅
(4)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,用电子式表示羰基硫分子的形成过程:
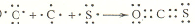 .
.
分析 (1)同主族,从上到下非金属性减弱,则最高价含氧酸的酸性越弱;
(2)第三周期原子半径最小的金属元素是铝,Al3+可与NH3•H2O反应产生Al(OH)3沉淀;
(3)根据R元素的原子结构(电子层数)和RO3,依据题给元素周期表可推知R元素为硒;
(4)COS分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,则C与O、C与S均形成两对共有电子对.
解答 解:(1)同主族,从上到下非金属性减弱,则最高价含氧酸的酸性越弱,非金属性As<P,则酸性H3AsO4<H3PO4,故答案为:<;
(2)第三周期原子半径最小的金属元素是铝,Al3+可与NH3•H2O反应产生Al(OH)3沉淀,反应离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(3)R元素的原子电子层数为4,处于第四周期,最高价氧化物的分子式为RO3,最高化合价为+6,处于ⅥA族,依据题给元素周期表可推知R元素为硒,故答案为:C;
(4)COS分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,则C与O、C与S均形成两对共有电子对,用电子式表示羰基硫分子的形成过程为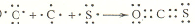 ,故答案为:
,故答案为: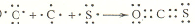 .
.
点评 本题考查位置、结构、性质的关系及应用,注意元素的位置与结构的对应关系及同主族性质的变化规律即可解答,题目难度不大.

练习册系列答案
相关题目
1.某有机物在氧气中充分燃烧,生成等物质的量的二氧化碳和水.则该有机物的组成必须满足的条件是( )
| A. | 分子中C、H、O的个数比为1:2:3 | B. | 分子中C、H的个数比为1:2 | ||
| C. | 该有机物的相对分子质量为14 | D. | 该分子中肯定不含氧 |
18.下列有关对定量实验误差分析正确的是( )
| A. | 现需90mL1.0mol/LNaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低 | |
| B. | 测定溶液 pH的实验中,用润湿的pH试纸测定新制氯水的pH--测定结果偏高 | |
| C. | 中和热实验测定中,缓慢地将NaOH溶液倒入测定装置中--对测定结果无影响 | |
| D. | 酸碱中和滴定实验中,标准液滴定前无气泡而滴定后有气泡--测定结果偏高 |
5.观察下列几个装置示意图,有关叙述正确的是( )
| A. |  装置中阳极上析出红色固体 | |
| B. |  装置的待镀铁制品应与电源负极相连 | |
| C. |  装置中粗铜应与电源负极相连 | |
| D. | 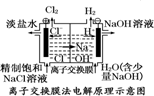 装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
2.为了有效的控制CO2的排放,工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{加热,加压}$CH3OH(g);△H<0.进行试验时所得实验图象如下则下列描述错误的是( )
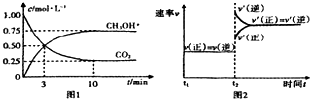

| A. | 平衡时该反应的平衡常数=$\frac{16}{3}(mol/L)^{-2}$ | |
| B. | 平衡时CO2的转化率为50% | |
| C. | t2时刻改变的条件是高温度 | |
| D. | 在0-3min时H2的反应速率为0.5mol•(L•min)-1 |

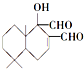 是一种取代有机氯农药DDT杀虫剂,其分子式为C15H22O3,它含有3种官能团,官能团的名称分别是碳碳双键、羟基、醛基
是一种取代有机氯农药DDT杀虫剂,其分子式为C15H22O3,它含有3种官能团,官能团的名称分别是碳碳双键、羟基、醛基 .
.