题目内容
9.A、B、C分别是由H、C、O、N、Na、Cu六种元素中的两种或多种元素组成的化合物.现对A、B、C三种化合物分别做以下实验:A是一种蓝色固体,B是无色晶体,其式量为68,C是白色固体,分别取A、B、C三种物质少量于三支试管中,加适量水溶解,发现A不溶于水,B、C都能溶于水,并且用pH试纸测定,B与C的水溶液都显碱性.
(1)取A物质少量于一支试管中,后加适量稀盐酸溶解,并用酒精灯微热,发现固体溶解时,伴有气泡产生.将56.8gA隔绝空气加热分解生成40g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水,生成的Y折合成标准状况下的体积为6.72L,则A的化学式为Cu5(OH)4(CO3)3或Cu5C3H4O13.
(2)取B的水溶液2ml与新制Cu(OH)2混合加热,发现能出现砖红色沉淀,则物质B为HCOONa.
(3)取16.8gC固体加强热,将生成的气体依次通过经称量过的装CaCl2固体的干燥管和装足量Ba(OH)2水溶液的洗气瓶,后经再次称量发现干燥管增重1.8g,洗气瓶增重4.4g.写出C物质加入水后的溶液显碱性的原因NaHCO3溶液中存在平衡:HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-,HCO3-水解程度大于电离程度,溶液显示碱性.(用离子方程式和必要文字解释)
分析 (1)A为不溶于水的蓝色固体,可能含有铜离子,再根据隔绝空气加热A生成黑色固体,黑色固体应该为氧化铜,根据标况下的密度可以计算出无色气体Y的摩尔质量,从而判断Y为二氧化碳,则A中一定含有碳酸根离子;再根据生成水的质量及碱式碳酸铜的组成判断A的化学式;
(2)根据B溶于水,溶液显示碱性,能够与新制氢氧化铜反应判断B为甲酸盐,再根据题干提供的元素名称判断B的名称;
(3)根据C加热生成二氧化碳和水判断C为碳酸氢盐,根据C为无色固体可知C为碳酸氢钠,由于碳酸根离子的水解程度大于其电离程度,则碳酸氢钠溶液显示碱性.
解答 解:(1)标准状况下,Y气体的密度为1.96g/L,Y的摩尔质量为:22.4L/mol×1.96g/L≈44g/mol,无色气体为二氧化碳,
40g黑色固体为CuO,物质的量为:$\frac{40g}{80g/mol}$=0.5mol,标况下6.72L二氧化碳的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,0.3mol二氧化碳的质量为:44g/mol×0.3mol=13.2g,
56.8g A分解生成水的质量为:56.8g-40g-13.2g=3.6g,水的物质的量为:$\frac{3.6g}{18g/mol}$=0.2mol,A为蓝色不溶于水的固体,联系碱式碳酸铜的组成可知,固体A中应该含有碳酸根离子、铜离子和氢氧根离子,根据原子守恒,n(Cu2+):n(OH):n(CO32-)=0.5mol:0.2mol×2:0.3mol=5:4:3,则A的化学式为:Cu5(OH)4(CO3)3或Cu5C3H4O13,
故答案为:Cu5(OH)4(CO3)3或Cu5C3H4O13;
(2)B是能够溶于水的晶体,B的溶液显示碱性,B与新制Cu(OH)2混合加热,能出现砖红色沉淀,B分子中一定含有醛基-CHO,B只能为甲酸盐,且式量为68,根据题干提供的元素,满足条件的只能为甲酸钠,
故答案为:HCOONa;
(3)氯化钙固体增重的为水的质量,氢氧化钡增重的4.4g为二氧化碳的质量,说明B加热分解生成二氧化碳和水,则C为碳酸氢盐,再根据C为无色固体,水溶液显示碱性,则C只能为碳酸氢钠,碳酸氢钠电离方程式为:HCO3-?H++CO32-;其水解方程式为:HCO3-+H2O?H2CO3+OH-,由于碳酸氢根离子的水解程度反应其电离程度,则碳酸氢钠溶液显示碱性,
故答案为:NaHCO3溶液中存在平衡:HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-,HCO3-水解程度大于电离程度,溶液显示碱性.
点评 本题考查了化学方程式的计算、无机推断,题目难度较大,涉及的知识点较多,注意掌握无机推断的方法与技巧,明确有关化学方程式的书写及计算方法.

 名校课堂系列答案
名校课堂系列答案| A. | 沸点:乙烷>戊烷>2-甲基丁烷 | B. | 熔点:Al>Na>Na和K的合金 | ||
| C. | 密度:苯<水<1,1,2,2-四溴乙烷 | D. | 热稳定性:HF>HCl>H2S |
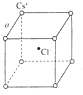 如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )| A. | $\frac{8M}{{N}_{A}{a}^{3}}$g•cm-3 | B. | $\frac{M{a}^{3}}{{8N}_{A}}$g•cm-3 | C. | $\frac{M}{{N}_{A}{a}^{3}}$g•cm-3 | D. | $\frac{M{a}^{3}}{{N}_{A}}$g•cm-3 |
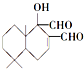 是一种取代有机氯农药DDT杀虫剂,其分子式为C15H22O3,它含有3种官能团,官能团的名称分别是碳碳双键、羟基、醛基
是一种取代有机氯农药DDT杀虫剂,其分子式为C15H22O3,它含有3种官能团,官能团的名称分别是碳碳双键、羟基、醛基 .
. .
.

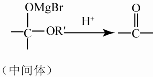
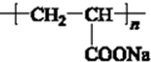

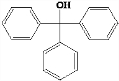 .
.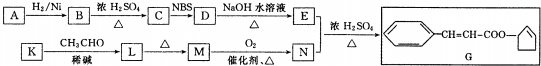
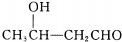
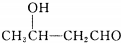 $\stackrel{△}{→}$CH3CH=CHCHO+H2O
$\stackrel{△}{→}$CH3CH=CHCHO+H2O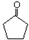 ,G中官能团的名称为碳碳双键、酯基.
,G中官能团的名称为碳碳双键、酯基.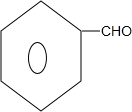 +CH3CH2OH$\stackrel{稀碱}{→}$
+CH3CH2OH$\stackrel{稀碱}{→}$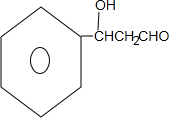 ,反应类型加成反应.
,反应类型加成反应.