题目内容
8.将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为2.24L.将反应后的固体残渣与过量的稀盐酸反应,又生成3.36L的CO2.(以上或以下气体体积均为标准状况时的体积),下列判断正确的是( )| A. | 原固体混合物中NaHCO3的物质的量为0.2mol | |
| B. | 固体残渣的成分为NaOH和Na2CO3的混合物 | |
| C. | 原固体混合物中NaOH和NaHCO3的物质的量之比为2﹕5 | |
| D. | 原固体混合物中加入过量盐酸会放出5.6L气体 |
分析 两次反应总共生成二氧化碳的体积为:2.24L+3.36L=5.6L,标况下二氧化碳的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,根据碳原子守恒可知,原混合物中碳酸钠的物质的量为0.25mol;
根据反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O可知,碳酸氢钠与氢氧化钠完全反应后剩余碳酸氢钠的物质的量为:$\frac{2.24L}{22.4L/mol}×2$=0.2mol,则与氢氧化钠反应的碳酸氢钠的物质的量为:0.25mol-0.2mol=0.05mol,
根据反应NaOH+NaHCO3=Na2CO3+H2O可知,氢氧化钠的物质的量为0.05mol,
根据以上分析对各选项进行判断.
解答 解:总共生成二氧化碳的体积为:2.24L+3.36L=5.6L,标况下二氧化碳的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol;根据碳原子守恒可知,原混合物中碳酸钠的物质的量为0.25mol;根据反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O可知,碳酸氢钠与氢氧化钠完全反应后剩余碳酸氢钠的物质的量为:$\frac{2.24L}{22.4L/mol}×2$=0.2mol,则与氢氧化钠反应的碳酸氢钠的物质的量为:0.25mol-0.2mol=0.05mol,根据反应NaOH+NaHCO3=Na2CO3+H2O可知,氢氧化钠的物质的量为0.05mol,
A.根据分析可知,原固体中碳酸氢钠的物质的量为0.25mol,故A错误;
B.固体残渣的成分为碳酸钠,没有氢氧化钠,故B错误;
C.原固体混合物中NaOH和NaHCO3的物质的量之比为:0.05mol:0.25mol=1﹕5,故C错误;
D.根据碳原子守恒,原固体混合物中加入过量盐酸会放出5.6L气体,故D正确;
故选D.
点评 本题考查混合物反应的有关计算,题目难度中等,明确发生的反应原理为解题关键,注意守恒思想在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | 现需90mL1.0mol/LNaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低 | |
| B. | 测定溶液 pH的实验中,用润湿的pH试纸测定新制氯水的pH--测定结果偏高 | |
| C. | 中和热实验测定中,缓慢地将NaOH溶液倒入测定装置中--对测定结果无影响 | |
| D. | 酸碱中和滴定实验中,标准液滴定前无气泡而滴定后有气泡--测定结果偏高 |
| A. | XO3- | B. | XO32- | C. | XO42- | D. | XO43- |
| A. | 碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液 Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2 H2O | |
| B. | 碳酸钠溶液与醋酸反应 CO32-+2H+=CO2↑+H2O | |
| C. | Ca (ClO)2溶液中通入过量的二氧化硫气体 ClO-+H2O+SO2=HSO3-+HClO | |
| D. | 硫化氢气体通入硫酸铁溶液中:H2S+2Fe3+=2Fe2++S↓+2H+ |
| A. | CH3-CH2-CH2-CH2-CH3和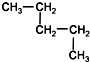 | B. | 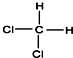 和 和 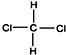 | ||
| C. | CH3-CH3和CH3-CH2-CH3 | D. | 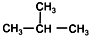 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
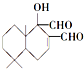 是一种取代有机氯农药DDT杀虫剂,其分子式为C15H22O3,它含有3种官能团,官能团的名称分别是碳碳双键、羟基、醛基
是一种取代有机氯农药DDT杀虫剂,其分子式为C15H22O3,它含有3种官能团,官能团的名称分别是碳碳双键、羟基、醛基 .
. .
.
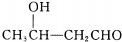
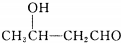 $\stackrel{△}{→}$CH3CH=CHCHO+H2O
$\stackrel{△}{→}$CH3CH=CHCHO+H2O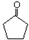 ,G中官能团的名称为碳碳双键、酯基.
,G中官能团的名称为碳碳双键、酯基.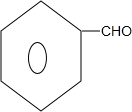 +CH3CH2OH$\stackrel{稀碱}{→}$
+CH3CH2OH$\stackrel{稀碱}{→}$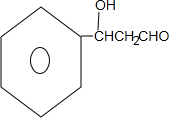 ,反应类型加成反应.
,反应类型加成反应.