题目内容
12.A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数的2倍,B是地壳中含量最多的元素,C是短周期中金属性最强的元素,D是同周期中阳离子半径最小的元素,E的最外层电子数与内层电子数之比为3:5,请用相关的化学用语回答下列问题:(1)F在周期表中位于第三周期ⅦA族.
(2)B、C按原子数之比1:1形成的化合物属于离子化合物(填“离子”或“共价”),该化合物的电子式
 .
.(3)AB2分子的电子式
 ,空间构型直线型,属于非极性分子(填“极性”或“非极性”)
,空间构型直线型,属于非极性分子(填“极性”或“非极性”)(4)B所在族的元素形成的气态氢化物中,沸点最低的物质是H2S(填化学式).
(5)写出D的单质与C的最高价氧化物对应水化物的溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑.
(6)C、D、E、F形成的简单离子半径由大到小的顺序为S2->Cl->Na+>Al3+(用离子符号表示).
分析 A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,A原子只能有2个电子层,最外层电子数为4,则A为碳元素;B是地壳中含量最多的元素,则B为O元素;C是短周期中金属性最强的元素,则C为Na;结合原子序数可知,D、E、F都处于第三周期,D是同周期中阳离子半径最小的元素,则D为Al;E的最外层电子数与内层电子数之比为3:5,则最外层电子数为6,故E为硫元素,F的原子序数最大,故F为Cl,据此解答.
解答 解:A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,A原子只能有2个电子层,最外层电子数为4,则A为碳元素;B是地壳中含量最多的元素,则B为O元素;C是短周期中金属性最强的元素,则C为Na;结合原子序数可知,D、E、F都处于第三周期,D是同周期中阳离子半径最小的元素,则D为Al;E的最外层电子数与内层电子数之比为3:5,则最外层电子数为6,故E为硫元素,F的原子序数最大,故F为Cl.
(1)F为Cl元素,原子核外有3个电子层、次外层电子数为7,处于周期表中第三周期ⅦA族,
故答案为:第三周期ⅦA族;
(2)B、C按原子数之比1:1形成的化合物为Na2O2,属于离子化合物,电子式为 ,
,
故答案为:离子; ;
;
(3)AB2分子为CO2,电子式为 ,空间构型为直线型,分子中正负电荷重心重合,属于非极性分子,
,空间构型为直线型,分子中正负电荷重心重合,属于非极性分子,
故答案为: ;直线型;非极性;
;直线型;非极性;
(4)B为O元素,水分子之间存在氢键,沸点故同主族其它非金属性元素氢化物,其氢化物中硫化氢的相对分子质量最小,分子间作用力最小,H2S的沸点最低,
故答案为:H2S;
(5)C的最高价氧化物对应水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(6)C、D、E、F形成的简单离子分别为:Na+、Al3+、S2-、Cl-,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Cl->Na+>Al3+,
故答案为:S2->Cl->Na+>Al3+.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,(4)中注意氢键对物质性质的影响,有利于基础知识的巩固.


| A. | 平衡时该反应的平衡常数=$\frac{16}{3}(mol/L)^{-2}$ | |
| B. | 平衡时CO2的转化率为50% | |
| C. | t2时刻改变的条件是高温度 | |
| D. | 在0-3min时H2的反应速率为0.5mol•(L•min)-1 |
| A. | 碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液 Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2 H2O | |
| B. | 碳酸钠溶液与醋酸反应 CO32-+2H+=CO2↑+H2O | |
| C. | Ca (ClO)2溶液中通入过量的二氧化硫气体 ClO-+H2O+SO2=HSO3-+HClO | |
| D. | 硫化氢气体通入硫酸铁溶液中:H2S+2Fe3+=2Fe2++S↓+2H+ |
| A. | 制半导体材料的元素 | B. | 制农药的元素 | ||
| C. | 制催化剂的元素 | D. | 制耐高温合金的元素 |
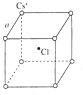 如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )| A. | $\frac{8M}{{N}_{A}{a}^{3}}$g•cm-3 | B. | $\frac{M{a}^{3}}{{8N}_{A}}$g•cm-3 | C. | $\frac{M}{{N}_{A}{a}^{3}}$g•cm-3 | D. | $\frac{M{a}^{3}}{{N}_{A}}$g•cm-3 |
| A. | C3H8 | B. | C4H10 | C. | C2H4Br2 | D. | C3H8O |
 .
.

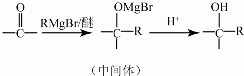



 .
.