题目内容
11.下列是几种原子的基态电子排布,电负性最大的原子是( )| A. | 1s22s22p4 | B. | 1s22s22p63s23p3 | ||
| C. | 1s22s22p3 | D. | 1s22s22p63s23p64s2 |
分析 不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性,即元素的非金属性越强其电负性越大.同一周期中,电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小,据此分析解答.
解答 解:A是O元素,B是P元素,C是N元素,D是Ca元素,所以非金属性最强的元素是O元素,即电负性最强的元素是O元素,
故选A.
点评 本题考查了元素非金属性强弱的判断,难度不大,明确元素的非金属性强弱与元素的电负性强弱关系是解答本题的关键.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
1.某有机物在氧气中充分燃烧,生成等物质的量的二氧化碳和水.则该有机物的组成必须满足的条件是( )
| A. | 分子中C、H、O的个数比为1:2:3 | B. | 分子中C、H的个数比为1:2 | ||
| C. | 该有机物的相对分子质量为14 | D. | 该分子中肯定不含氧 |
2.为了有效的控制CO2的排放,工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{加热,加压}$CH3OH(g);△H<0.进行试验时所得实验图象如下则下列描述错误的是( )
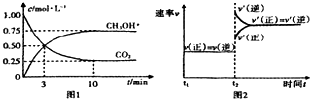

| A. | 平衡时该反应的平衡常数=$\frac{16}{3}(mol/L)^{-2}$ | |
| B. | 平衡时CO2的转化率为50% | |
| C. | t2时刻改变的条件是高温度 | |
| D. | 在0-3min时H2的反应速率为0.5mol•(L•min)-1 |
6. A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )
A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )
 A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )
A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )| A. | C→A的反应类型为加成反应 | |
| B. | 若A为2-丙醇,则其可实现如右图的所有转化 | |
| C. | 若A、B、D、为链状化合物,则C也一定为链状化合物 | |
| D. | A的相对分子质量小于C、D的相对分子质量而大于B的相对分子质量 |
16.原子序数小于10的元素X,其原子最外层中未成对电子数最多,含这种元素的阴离子可能是( )
| A. | XO3- | B. | XO32- | C. | XO42- | D. | XO43- |
3.下列离子方程式书写正确的是( )
| A. | 碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液 Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2 H2O | |
| B. | 碳酸钠溶液与醋酸反应 CO32-+2H+=CO2↑+H2O | |
| C. | Ca (ClO)2溶液中通入过量的二氧化硫气体 ClO-+H2O+SO2=HSO3-+HClO | |
| D. | 硫化氢气体通入硫酸铁溶液中:H2S+2Fe3+=2Fe2++S↓+2H+ |
1.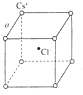 如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
 如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )| A. | $\frac{8M}{{N}_{A}{a}^{3}}$g•cm-3 | B. | $\frac{M{a}^{3}}{{8N}_{A}}$g•cm-3 | C. | $\frac{M}{{N}_{A}{a}^{3}}$g•cm-3 | D. | $\frac{M{a}^{3}}{{N}_{A}}$g•cm-3 |
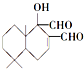 是一种取代有机氯农药DDT杀虫剂,其分子式为C15H22O3,它含有3种官能团,官能团的名称分别是碳碳双键、羟基、醛基
是一种取代有机氯农药DDT杀虫剂,其分子式为C15H22O3,它含有3种官能团,官能团的名称分别是碳碳双键、羟基、醛基 .
.