题目内容
14.将5.6 L(标准状况)乙烯和甲烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了2.8 g.原混合气体中乙烯与甲烷的质量比是( )| A. | 2:1 | B. | 2:3 | C. | 7:6 | D. | 7:3 |
分析 乙烯与溴发生加成反应,溴的四氯化碳溶液增加的质量为乙烯的质量,计算混合气体、乙烯的物质的量,进而计算甲烷的物质的量,再计算甲烷的质量,据此进行计算.
解答 解:乙烯与溴发生加成反应,甲烷不与溴反应,则溴的四氯化碳溶液增加的2.8g为乙烯的质量,则:m(C2H4)=2.8g,n(C2H4)=$\frac{2.8g}{28g/mol}$=0.1mol,
而n(CH4)+n(C2H4)=$\frac{5.6L}{22.4L/mol}$=0.25mol,
所有混合气体中含有甲烷的物质的量为:n(CH4)=0.25mol-0.1mol=0.15mol,
故m(CH4)=0.15mol×16g/mol=2.4g,
故原混合气体中乙烯与甲烷的质量比为:2.8g:2.4g=7:6,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,根据乙烯与溴发生加成反应确定乙烯的质量为解答关键,注意掌握常见有机物结构与性质,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
4.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍.其电池反应为:2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O,则下列说法错误的是( )
| A. | 放电时负极的电极反应为:CH3OH-6e-+8OH-═CO${\;}_{3}^{2-}$+6H2O | |
| B. | 充电时电解质溶液的pH逐渐增大 | |
| C. | 放电时CH3OH参与反应的电极为正极 | |
| D. | 充电时每生成1 mol CH3OH转移6 mol电子 |
5.在反应 3NO2+H2O→2HNO3+NO 中NO2的作用是( )
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
9.下列物质中,含有极性共价键的离子化合物是( )
| A. | MgO | B. | NaCl | C. | NaOH | D. | H2O2 |
19.在体积恒定的密闭容器中,不能说明可逆反应2A(g)?3B(g)+2C(g)已达到平衡状态的是(一定温度下)( )
| A. | 密闭容器中混和气体的密度不再发生变化 | |
| B. | 混和气体的平均相对分子质量不再发生变化 | |
| C. | 单位时间内生成3mol B的同时有2mol A生成 | |
| D. | A的生成速率与A的分解速率相等 |
6.如图为铜-锌-稀硫酸构成的原电池示意图,下列说法正确的是( )
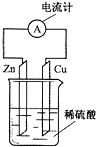

| A. | 锌片为正极,且锌片逐渐溶解 | B. | 铜片为负极,且铜片上有气泡 | ||
| C. | 溶液中的H+移向铜极 | D. | 该装置能将电能转变为化学能 |
4.将100mL溶液中含硫酸0.01mol、硝酸0.04mol,若在该溶液中投入1.92g铜粉微热,反应后放出一氧化氮气体标准状况下体积约为( )
| A. | 0.448L | B. | 0.336L | C. | 0.224L | D. | 无法计算 |

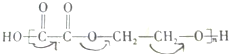 )是一种重要的化工原料,某种由A制备G的工艺流程如下,请回答:
)是一种重要的化工原料,某种由A制备G的工艺流程如下,请回答: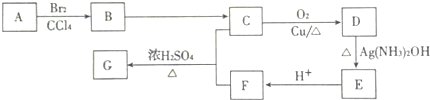
 +(2n-1)H2O.
+(2n-1)H2O.