题目内容
2.某实验小组用下列装置进行乙醇催化氧化的实验.(1)实验过程中铜网出现红色和黑色交替的现象,请写出该过程中的总化学反应方程式:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO、CH3CH2OH+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CH3CHO+Cu+H2O;
(2)甲和乙两个水浴作用不相同.他们的作用依次为加热、冷却;
(3)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸.要除去该物质,可在混合液中加入C填写字母);
A.氯化钠溶液B.苯 C.碳酸氢钠溶液D.四氯化碳
然后,再通过蒸馏(填实验操作名称)即可除去;
(4)实验一段时间后,将试管a中的液体取出,加入足量的银氨溶液,再放入甲烧杯中,很快出现明显的现象.写出该反应的化学方程式:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COONH4+H2O+2Ag↓+3NH3;反应类型为氧化反应

分析 (1)乙醇的催化氧化反应实质是:金属铜被氧气氧化为氧化铜,氧化铜将乙醇氧化为乙醛,金属铜起催化剂作用;
(2)乙是冷水浴,目的是将乙醛冷却下来,根据物质的沸点高低不同来确定获得的物质,结合空气的成分以及发生的反应确定剩余的气体成分;
(3)能使紫色石蕊试纸变红的是酸,碳酸氢钠可以和乙酸反应;分离相互溶解的液体需要通过蒸馏操作;
(4)乙醛分子中含有醛基,能够发生有机反应,写出乙醛发生银镜反应的化学方程式.
解答 解:(1)乙醇的催化氧化反应过程:金属铜被氧气氧化为氧化铜:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,氧化铜将乙醇氧化为乙醛:CH3CH2OH+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CH3CHO+Cu+H2O,
故答案为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO、CH3CH2OH+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CH3CHO+Cu+H2O;
(2)根据反应流程可知:在甲处用热水浴加热使乙醇挥发与空气中的氧气混合,有利于下一步反应;乙处作用为冷水浴,降低温度,使生成的乙醛冷凝成为液体,沉在试管的底部,
故答案为:加热、冷却,
(3)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,四个选择答案中,只有C.酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳;实现两种互溶物质的分离用蒸馏法,
故答案为:乙酸;C;蒸馏;
(4)乙醛与银氨溶液发生有机反应,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COONH4+H2O+2Ag↓+3NH3,乙醛发生了氧化反应,
故答案为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COONH4+H2O+2Ag↓+3NH3;氧化反应.
点评 本题考查了乙醇的催化氧化实验,题目难度中等,明确乙醇的催化反应历程是解答的关键,试题培养了学生的分析、理解能力及化学实验能力.

| A. | 达平衡时同一物质的V(正)=V(逆) | B. | 是动态平衡 | ||
| C. | 各组分的含量不随时间而变化 | D. | 外界条件不能改变平衡 |
①苯和水;
②乙酸乙酯和乙醇;
③乙酸乙酯和纯碱溶液;
④苯和溴苯;
⑤硝基苯和水;
⑥蔗糖与葡萄糖.
| A. | ①③⑤ | B. | ①④⑤⑥ | C. | ①②③ | D. | ②③⑤ |
| A. | 通入澄清石灰水 | |
| B. | 先通入酸性KMnO4溶液,再通入石灰水 | |
| C. | 通入品红溶液 | |
| D. | 先通入饱和NaHCO3溶液,在通入石灰水 |
| A. | 用漫射散光照射甲烷与氯气的混合气体 | |
| B. | 乙烯通入溴水中 | |
| C. | 在镍做催化剂的条件下,苯与氢气反应 | |
| D. | 乙醇与酸性高锰酸钾溶液反应 |
| A. | 2:1 | B. | 2:3 | C. | 7:6 | D. | 7:3 |
| A. | 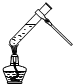 葡萄糖的银镜反应 | B. | 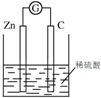 形成原电池 | ||
| C. | 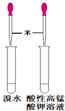 检验苯中有无碳碳双键 | D. | 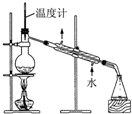 石油的分馏 |
| A. | ④<①<③<② | B. | ①<④<③<② | C. | ①<②<③<④ | D. | ④<③<①<② |