题目内容
4.将100mL溶液中含硫酸0.01mol、硝酸0.04mol,若在该溶液中投入1.92g铜粉微热,反应后放出一氧化氮气体标准状况下体积约为( )| A. | 0.448L | B. | 0.336L | C. | 0.224L | D. | 无法计算 |
分析 铜与稀硝酸反应的实质是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,只要Cu与硫酸足量,NO3-可以被完全还原,n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,计算溶液中H+、NO3-的物质的量,根据离子方程式进行过量计算,根据不足量的物质计算n(NO),再根据V=nVm计算NO体积.
解答 解:n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,
n(H+)=2×0.01mol+0.04mol=0.06mol,n(NO3-)=0.04mol,
3 Cu+2 NO3-+8 H+=3Cu2++2NO↑+4H2O
0.03mol 0.02mol 0.08mol
则H+不足,Cu、NO3-过量,由方程式可知n(NO)=$\frac{1}{4}$×0.06mol=0.015mol,
所得NO体积在标准状况下为0.015mol×22.4L/mol=0.336L,
故选B.
点评 本题考查化学方程式有关计算,题目难度中等,注意酸性条件下硝酸根有强氧化性,利用离子方程式进行过量计算,避免利用化学方程式的繁琐计算.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
14.将5.6 L(标准状况)乙烯和甲烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了2.8 g.原混合气体中乙烯与甲烷的质量比是( )
| A. | 2:1 | B. | 2:3 | C. | 7:6 | D. | 7:3 |
15.下列各组顺序的排列不正确的是( )
| A. | 酸性强弱:HClO4>H2SO4>H3PO4 | B. | 离子半径:Na+>Mg2+>Al3+>F- | ||
| C. | 热稳定性:HCl>H2S>PH3>SiH4 | D. | 氧化性:K+<Na+<Mg2+<Al3+ |
12.一定温度下、物质的量浓度相同的四种溶液:①CH3COONa、②NaHSO4、③NaCl、④C6H5ONa,溶液中c(H+)的排顺正确的是( )
| A. | ④<①<③<② | B. | ①<④<③<② | C. | ①<②<③<④ | D. | ④<③<①<② |
19. 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Mg;
(2)甲同学的实验目的是探究金属(反应物)本身的性质与反应速率的关系;要得出正确的实验结论,还需要控制的实验条件是温度相同.
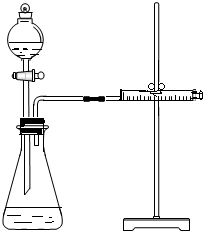
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间;
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ②分别投入大小、形状相同的Cu、Fe、Mg | 反应速率Mg>Fe,Cu反应最慢 | 金属性质越活泼,反应 速率越快 |
(2)甲同学的实验目的是探究金属(反应物)本身的性质与反应速率的关系;要得出正确的实验结论,还需要控制的实验条件是温度相同.
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间;
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
9.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 125g CuSO4•5H2O晶体中含有Cu2+离子数一定小于0.5NA | |
| B. | 常温下,pH=3的醋酸溶液中,醋酸分子的数目一定大于10-3NA | |
| C. | 由S6、S7、S8组成的硫蒸气6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 3.6g C与3.36L O2一定条件下恰好完全反应,生成CO分子数一定为0.3NA |
14.下列关于化学用语的表示正确的是( )
| A. | 羟基的电子式为: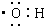 | |
| B. | 甘氨酸的结构简式为:C2H5NO2 | |
| C. | 间羟基苯甲酸的结构简式为: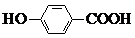 | |
| D. | Na2S在溶液中水解的离子方程式为:S2-+2H2O?H2S+2OH- |
15.热化学方程式中的物质必须要注明聚集状态,原因是( )
| A. | 能描述出反应发生的状态 | B. | 说明反应条件 | ||
| C. | 为了区别一般的化学方程式 | D. | 物质呈现的状态与反应热有关 |