题目内容
5.在反应 3NO2+H2O→2HNO3+NO 中NO2的作用是( )| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
分析 氧化还原反应中存在元素化合价降低的物质为氧化剂,存在元素化合价升高的物质为还原剂,据此分析.
解答 解:氧化还原反应中存在元素化合价降低的物质为氧化剂,存在元素化合价升高的物质为还原剂,3NO2+H2O→2HNO3+NO中NO2中的N元素部分化合价升高,部分化合价降低,所以NO2既是氧化剂又是还原剂,
故选C.
点评 本题考查了氧化还原反应,侧重于基本概念的考查,题目难度不大,注意从化合价的角度分析.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
15.能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中加入CH3COONa晶体 | D. | 向水中加入NH4Cl溶液 |
16.下表是元素周期表中短周期元素部分,表中字母分别代表一种元素:
(1)上述化学性质最不活泼的元素是氦(填元素名称).
(2)画出h的原子结构示意图 ,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)c、d、g离子半径由小到大的顺序是O2->Na+>Al3+ (用离子符号表示).
(4)表中元素g的氢化物稳定性>(填“>”或“<”)元素e的氢化物稳定性.
(5)c元素最高价氧化物的水化物中含有离子键、共价键(填化学键类型),该物质不能储存在带玻璃塞的试剂瓶中的原因:SiO2+2NaOH=Na2SiO3+H2O(用化学方程式表示).
| a | b | ||||||
| e | f | g | |||||
| c | d | h | i | j | |||
(2)画出h的原子结构示意图
 ,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.(3)c、d、g离子半径由小到大的顺序是O2->Na+>Al3+ (用离子符号表示).
(4)表中元素g的氢化物稳定性>(填“>”或“<”)元素e的氢化物稳定性.
(5)c元素最高价氧化物的水化物中含有离子键、共价键(填化学键类型),该物质不能储存在带玻璃塞的试剂瓶中的原因:SiO2+2NaOH=Na2SiO3+H2O(用化学方程式表示).
13.下列各组物质可以直接通过分液进行分离的组合是( )
①苯和水;
②乙酸乙酯和乙醇;
③乙酸乙酯和纯碱溶液;
④苯和溴苯;
⑤硝基苯和水;
⑥蔗糖与葡萄糖.
①苯和水;
②乙酸乙酯和乙醇;
③乙酸乙酯和纯碱溶液;
④苯和溴苯;
⑤硝基苯和水;
⑥蔗糖与葡萄糖.
| A. | ①③⑤ | B. | ①④⑤⑥ | C. | ①②③ | D. | ②③⑤ |
20.如图所示Cu-Zn原电池,下列叙述正确的是( )
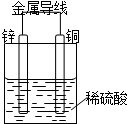

| A. | 锌为负极,发生氧化反应 | B. | 铜为负极,铜片上有气泡产生 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 溶液中的SO42-移向正极 |
10.能够证明SO2中含有CO2的方法是将气体( )
| A. | 通入澄清石灰水 | |
| B. | 先通入酸性KMnO4溶液,再通入石灰水 | |
| C. | 通入品红溶液 | |
| D. | 先通入饱和NaHCO3溶液,在通入石灰水 |
14.将5.6 L(标准状况)乙烯和甲烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了2.8 g.原混合气体中乙烯与甲烷的质量比是( )
| A. | 2:1 | B. | 2:3 | C. | 7:6 | D. | 7:3 |
15.下列各组顺序的排列不正确的是( )
| A. | 酸性强弱:HClO4>H2SO4>H3PO4 | B. | 离子半径:Na+>Mg2+>Al3+>F- | ||
| C. | 热稳定性:HCl>H2S>PH3>SiH4 | D. | 氧化性:K+<Na+<Mg2+<Al3+ |