题目内容
9.下列物质中,含有极性共价键的离子化合物是( )| A. | MgO | B. | NaCl | C. | NaOH | D. | H2O2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,碱金属、碱土金属和氧族、卤族元素之间易形成离子键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:A.MgO中镁离子和氧离子之间只存在离子键,为离子化合物,故A错误;
B.氯化钠中钠离子和氯离子之间只存在离子键,为离子化合物,故B错误;
C.氢氧化钠中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,为离子化合物,故C正确;
D.双氧水分子中H-O原子之间存在极性键、O-O原子之间存在非极性键,为共价化合物,故D错误;
故选C.
点评 本题考查化学键和化合物类型判断,明确物质构成微粒及微粒之间作用力即可解答,注意双氧水中存在的化学键,注意不能根据是否含有金属元素判断离子化合物,为易错点.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
19.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: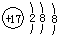 | B. | CH4分子的球棍模型: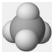 | ||
| C. | 氯化镁的电子式: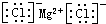 | D. | N2的结构式: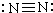 |
20.如图所示Cu-Zn原电池,下列叙述正确的是( )
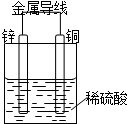

| A. | 锌为负极,发生氧化反应 | B. | 铜为负极,铜片上有气泡产生 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 溶液中的SO42-移向正极 |
4.现有7瓶失去标签的液体,已知它们是有机试剂,可能是:①乙醇、②乙酸、③苯、④乙酸乙酯、⑤油脂、⑥葡萄糖溶液、⑦蔗糖溶液,现通过如下实验来确定各试剂瓶中所装的液体:
试给它们的试剂瓶重新贴上标签,其中:
A乙醇,C苯,E油脂,F葡萄糖,G蔗糖溶液.
| 实验步骤和方法 | 实验现象 |
| ①把7瓶液体分别依次标号A?B?C?D?E?F?G后,闻气味 | 只有F?G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有C?E?D三种液体不溶解而浮在水面上 |
| ③分别取少量7种液体于试管中加新 制Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取少量C?E?D于试管中,加稀NaOH 溶液并加热 | 只有C仍有分层现象,且在D的试管中闻 到特殊香味 |
A乙醇,C苯,E油脂,F葡萄糖,G蔗糖溶液.
14.将5.6 L(标准状况)乙烯和甲烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了2.8 g.原混合气体中乙烯与甲烷的质量比是( )
| A. | 2:1 | B. | 2:3 | C. | 7:6 | D. | 7:3 |
1.试剂B、C分别是( )
| A. | NaOH、CuSO4 | B. | NaOH、新制Cu(OH)2 | C. | Na2CO3、CuSO4 | D. | H2SO4、新制Cu(OH)2 |
18.下列有关问题,与盐的水解无关的是( )
| A. | 用盐酸除铁锈 | |
| B. | 用纯碱溶液清洗油污 | |
| C. | 加热蒸干AlCl3溶液得到Al(OH)3固体 | |
| D. | 实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
19. 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Mg;
(2)甲同学的实验目的是探究金属(反应物)本身的性质与反应速率的关系;要得出正确的实验结论,还需要控制的实验条件是温度相同.
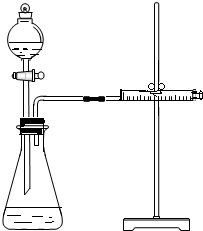
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间;
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ②分别投入大小、形状相同的Cu、Fe、Mg | 反应速率Mg>Fe,Cu反应最慢 | 金属性质越活泼,反应 速率越快 |
(2)甲同学的实验目的是探究金属(反应物)本身的性质与反应速率的关系;要得出正确的实验结论,还需要控制的实验条件是温度相同.
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间;
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.