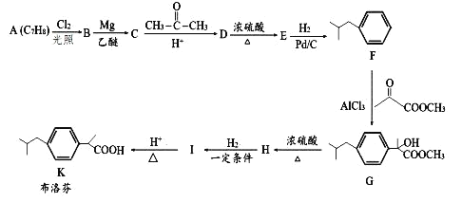
题目内容
【题目】在标准状况下,①![]() 氮气②
氮气②![]() 二氧化碳③
二氧化碳③![]() ,含分子数最多的是__________(填序号,下同);质量最大的是__________;体积最小的是_________。
,含分子数最多的是__________(填序号,下同);质量最大的是__________;体积最小的是_________。
【答案】② ② ①
【解析】
根据![]() 计算氮气、二氧化碳、氧气的物质的量,物质的量越大,分子数越多,相同状况下,体积越大,根据m=nM计算氮气、二氧化碳、氧气的质量。
计算氮气、二氧化碳、氧气的物质的量,物质的量越大,分子数越多,相同状况下,体积越大,根据m=nM计算氮气、二氧化碳、氧气的质量。
①![]() 氮气的物质的量为
氮气的物质的量为![]() ;
;
②![]() 二氧化碳的物质的量为
二氧化碳的物质的量为![]() ,其质量为3mol×44g/mol=132g;
,其质量为3mol×44g/mol=132g;
③![]() 的物质的量为
的物质的量为![]() ,其质量为1.5mol×32g/mol=48g;
,其质量为1.5mol×32g/mol=48g;
由此可知,质量最大的是②二氧化碳,三种分子的物质的量由大到小的顺序为②③①,又因为物质的量越大,分子数越多,相同状况下,气体体积越大,则可知含分子数最多的是②二氧化碳,体积最小的是①氮气,故答案为:②;②;①。

练习册系列答案
相关题目