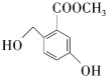
题目内容
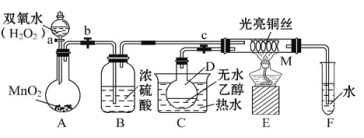
【题目】I.如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
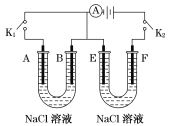
(1)断开K2,闭合K1时。B为___极,A的电极反应为_______,最终可观察到的现象是________。
(2)断开K1,闭合K2时。E为_____极,F极的电极反应为_____,检验F极产物的方法是___。
(3)若往U形管中滴加酚酞试液,进行(1)(2)操作时,A、B、E、F电极周围能变红的是____。
Ⅱ.如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。
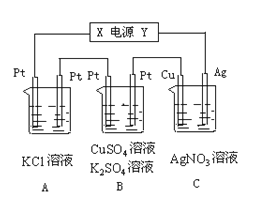
试回答:
(1)电源电极X名称为____。
(2)pH变化:A池_____, B池______, C池____。
(3)写出B池中所发生的电解反应方程式: _________。
【答案】负 O2+4e-+2H2O=4OH- 溶液中有红褐色沉淀生成 阴 2Cl--2e-=Cl2↑ 用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气 AE 负极 变大 变小 不变 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
【解析】
(1)断开K2,闭合K1时,左端U形管没有外接直流电源,则形成原电池,相对活泼的电极为负极,则B为负极,电极反应为Fe-2e- =Fe2+;A为正极,发生吸氧腐蚀,电极反应为O2+4e-+2H2O=4OH-。两电极产物反应生成Fe(OH)2,然后发生4Fe(OH)2+O2+2H2O=4Fe(OH)3,最终可观察到的现象是溶液中有红褐色沉淀生成。答案为:负;O2+4e-+2H2O=4OH-;溶液中有红褐色沉淀生成;
(2)断开K1,闭合K2时,右端U形管形成电解池,与电源正极相连的F极为阳极,则E为阴极;在F极,Cl-失电子生成Cl2,电极反应为2Cl--2e-=Cl2↑,检验F极产物Cl2,可使用湿润的淀粉碘化钾试纸,具体方法是:用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气。答案为:阴;2Cl--2e-=Cl2↑;用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气;
(3)若往U形管中滴加酚酞试液,进行(1)(2)操作时,A极反应为 O2+4e-+2H2O=4OH-,B极反应为Fe-2e- =Fe2+,E极反应为2H2O+2e-=2OH-+H2↑,F极反应为2Cl--2e-=Cl2↑,则电极周围能变红的是AE。答案为:AE;
Ⅱ.电解5min时,铜电极质量增加2.16g,则Cu电极为阴极,Ag电极为阳极,与它相连的电源Y电极为正极,X电极为负极。A池中,左端Pt电极为阴极,右端Pt电极为阳极,电池反应为2KCl+2H2O![]() 2KOH+Cl2↑+H2↑;B池中,左端Pt电极为阴极,右端Pt电极为阳极,电池反应为2CuSO4+2H2O
2KOH+Cl2↑+H2↑;B池中,左端Pt电极为阴极,右端Pt电极为阳极,电池反应为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() 2H2↑+O2↑(B池的两极都有气体产生,所以有后一反应发生);C池中,Cu电极反应Ag++e- =Ag,Ag电极反应Ag-e- =Ag+。
2H2↑+O2↑(B池的两极都有气体产生,所以有后一反应发生);C池中,Cu电极反应Ag++e- =Ag,Ag电极反应Ag-e- =Ag+。
(1)依上面分析,电源电极X名称为负极。答案为:负极;
(2)从上面分析可知,pH变化:A池变大, B池变小, C池不变。答案为:变大;变小;不变;
(3)由分析知,B池中所发生的电解反应方程式:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() 2H2↑+O2↑。答案为:2CuSO4+2H2O
2H2↑+O2↑。答案为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() 2H2↑+O2↑。
2H2↑+O2↑。