题目内容
【题目】Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。回答下列问题:
(1)Mg、Ni、Cu 等金属可能形成金属互化物。金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、 “等于”或“小于”),理由是_____________________。
(3)[Ni(NH3)6](NO3)2 中不存在的化学键为___________(填序号)。
a.离子键 b.金属键 c.配位键 d.氢键
(4)镍基合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。
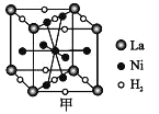
该合金储氢后,H2 与 Ni 的物质的量之比为___________。
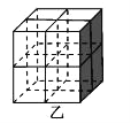
②Mg2NiH4 是一种储氢的金属氢化物。在 Mg2NiH4 晶胞中,Ni 原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于 Ni 原子形成的___________ (填“八面体空隙”或“四面体空隙”)。 晶体的密度为ρg·cm-3,NA表示阿伏加德罗常数,Mg2+和 Ni 原子的最短距离为__________cm(用含ρ和 NA 的代数式表示)。
【答案】X—射线衍射实验 小于 Zn原子轨道中电子处于全满状态,较难失电子,Cu失去一个电子内层电子达到全充满稳定状态 b 3:5 四面体空隙 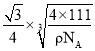
【解析】
(1)确定某种金属互化物是晶体还是非晶体可通过X—射线衍射实验测定;
(2)轨道中电子处于全满、全空、半满时较稳定,失去电子需要的能量较大,Zn原子轨道中电子处于全满状态,Cu失去一个电子内层电子达到全充满稳定状态,所以Cu较Zn易失电子;
(3)[Ni(NH3)6](NO3)2中NH3与Ni2+之间为配位键;[Ni(NH3)6]2+与NO3-之间为离子键;
(4)①根据晶胞结构示意图计算晶胞中H2 与 Ni个数比;
②Ni 原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心,则Mg2+位于 Ni 原子形成四面体空隙;Mg2+和 Ni 原子的最短距离为晶胞体对角线的![]() ,再根据晶胞密度计算。
,再根据晶胞密度计算。
(1)确定某种金属互化物是晶体还是非晶体可通过X—射线衍射实验测定,故答案为:X—射线衍射实验;
(2)轨道中电子处于全满、全空、半满时较稳定,失去电子需要的能量较大,基态Cu的核外电子排布式为[Ar]3d104s1,基态Zn的核外电子排布式为[Ar]3d104s2,Zn原子轨道中电子处于全满状态,较难失电子,而Cu失去1个电子成为Cu+:[Ar]3d10,,Cu+达到全满结构,较稳定,Cu失去1个电子更容易,则第一电离能Cu<Zn,故答案为:小于;Zn原子轨道中电子处于全满状态,较难失电子,Cu失去一个电子内层电子达到全充满稳定状态;
(3)[Ni(NH3)6](NO3)2中NH3与Ni2+之间为配位键;[Ni(NH3)6]2+与NO3-之间为离子键,不存在金属键,故答案为:b;
(4)①根据晶胞结构示意图计算晶胞中H2数目为![]() ,Ni数目为
,Ni数目为![]() ,则H2 与 Ni 的物质的量之比为3:5,故答案为:3:5;
,则H2 与 Ni 的物质的量之比为3:5,故答案为:3:5;
②Ni 原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心,则Mg2+位于 Ni 原子形成四面体空隙;该晶胞中Ni原子个数![]() ,Mg2+个数为8,由化学式可知H原子个数为16,则晶胞质量为
,Mg2+个数为8,由化学式可知H原子个数为16,则晶胞质量为![]() ,晶体的密度为ρg·cm-3,则晶胞的边长为:
,晶体的密度为ρg·cm-3,则晶胞的边长为: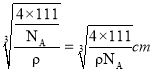 ,Mg2+和 Ni 原子的最短距离为晶胞体对角线的
,Mg2+和 Ni 原子的最短距离为晶胞体对角线的![]() ,则Mg2+和 Ni 原子的最短距离为
,则Mg2+和 Ni 原子的最短距离为 ,故答案为:四面体空隙;
,故答案为:四面体空隙;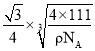 。
。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案