题目内容
14.Mn(OH)2常用作油漆催干剂.向MnSO4溶液加入NaOH溶液,待沉淀完全后,过滤,洗涤,烘干即可制得Mn(OH)2.(1)已知:常温下Mn(OH)2的Ksp=1.0×10-15.如果要使溶液中Mn2+沉淀完全,则应该保持溶液中c(OH-)≥1×10-5mol•L-1[当c(Mn2+)≤10-5mol/L时,即可认为溶液中Mn2+沉淀完全].
(2)Mn(OH)2还可以通过MnO2与二氧化硫气体充分接触,再与石灰乳反应制得,写出该反应的总的化学方程式MnO2+SO2+Ca(OH)2=Mn(OH)2+CaSO4.
(3)一种含Mn2+的结晶水合物组成为AxMnyBz•mH2O(A表示一种阳离子,B表示一种阴离子).现称取39.10g晶体配成100mL溶液X,取20mL溶液X,向其中加入足量的氢氧化钠溶液,加热,得到896mL气体(标准状况);另取20mL溶液X,向其中加入盐酸,无沉淀产生,再加入BaCl2溶液,产生白色沉淀,过滤,洗涤,烘干,得到固体9.32g.
①A、B的离子符号分别为NH4+、SO42-.
②通过计算确定该结晶水合物的化学式(写出计算过程).
分析 (1)当c(Mn2+)≤10-5mol/L时,即可认为溶液中Mn2+沉淀完全,依据Mn(OH)2的Ksp=1.0×10-15计算此时氢氧根的浓度即可;
(2)依据题给信息:反应物分别为二氧化锰、二氧化硫、氢氧化钙,生成物为:氢氧化锰,结合氧化还原反应得失电子守恒书写即可;
(3)与足量氢氧化钠反应放出气体,说明含有铵根,能与氯化钡反应生成难溶于酸的沉淀,说明含有硫酸根离子,据此解答即可.
解答 解:(1)Ksp=1.0×10-15=c(Mn2+)×c(OH-)2=1×10-5,由于当c(Mn2+)≤10-5mol/L时,即可认为溶液中Mn2+沉淀完全,故此时c(OH-)=$\sqrt{\frac{1×1{0}^{-15}}{1×1{0}^{-5}}}$=1×10-5,故要使溶液中Mn2+沉淀完全,则应该保持溶液中c(OH-)≥1×10-5,故答案为:1×10-5;
(2)由题意可知,二氧化锰具有氧化性,二氧化硫具有还原性,故化学反应方程式为:MnO2+SO2+Ca(OH)2=Mn(OH)2+CaSO4,故答案为:MnO2+SO2+Ca(OH)2=Mn(OH)2+CaSO4;
(3)①依据题意得出此物质水溶液能与氢氧化钠反应生成氨气,说明含有NH4+,能与氯化钡反应生成白色难溶于盐酸的沉淀,说明此溶液中含有SO42-,
故答案为:NH4+;SO42-;
②气体为氨气,据此得出:n(NH4+)=n(NH3)×5=0.896 L÷22.4 L/mol×5=0.2 mol
白色沉淀为硫酸钡,据此得出n(SO42-)=n(BaSO4)×5=9.32 g÷233 g/mol×5=0.2 mol
根据电荷守恒:n(NH4+)+2n(Mn2+)=2n(SO42-)
n(Mn2+)=(2×0.2 mol-0.2 mol)÷2=0.1 mol
n(H2O)=(39.1 g-0.2 mol×18 g/mol-0.1 mol×55 g/mol-0.2 mol×96g/mol)÷18 g/mol=0.6mol
故该结晶水合物的化学式为:(NH4)2Mn (SO4)2•6H2O,
答:结晶水合物的化学式为(NH4)2Mn (SO4)2•6H2O.
点评 本题主要考查的是溶度积常数的应用、氧化还原反应原理应用、溶液中离子的判断以及物质的量的有关计算,综合性较强,有一定难度.

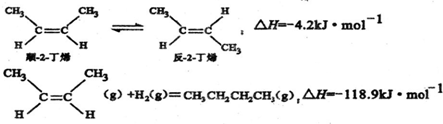
| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: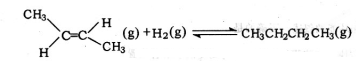 △H=-123.1kJ•mol-1 △H=-123.1kJ•mol-1 |
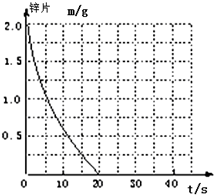 兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.
兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.(1)酸液都取足量、相同体积,请你帮助完成以下面实验设计表(表中不要留空格):
| 实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
| ① | 298 | 0.20mol/L | / | a.实验①和②是探究不同温度对锌与盐酸反应速率的影响; b.实验①和③是探究不同浓度对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与锌反应速率的区别. |
| ② | 308 | 0.20mol/L | / | |
| ③ | 298 | 0.40mol/L | / | |
| ④ | 298 | / | 0.20 |
(3)某实验小组在做(1)中实验④时误加少量0.10mol/L CuCl2溶液,发现反应速率与(1)中实验①接近.该组同学对影响因素提出如下假设,请完成假设三:
假设一:Cu2+对该反应起催化剂作用
假设二:Cl-对该反应起催化剂作用
假设三:形成Zn-Cu原电池,加快反应速率(其它答案合理亦可)
…
(4)请你设计实验验证上述假设三是否成立,写出实验步骤及预期现象:
| 实验步骤 | 预期现象 |
| ①将不连接的铜、锌电极插入稀硫酸中,②将铜、锌电极用导线连接放入稀硫酸中 | 产生氢气的速率②大于①,证明构成原电池后可以大大加快反应速率 |
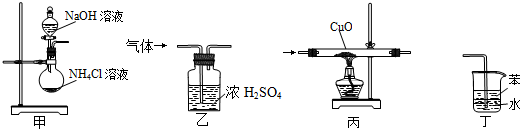
| A. | 用装置甲制取氨气 | B. | 用装置乙除去氨气中的水蒸气 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收氨气 |
| A. | 0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA | |
| B. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)] | |
| C. | 一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA | |
| D. | 电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g |
| A. | 加碘食盐能使淀粉溶液变蓝 | |
| B. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物属于胶体 | |
| C. | 装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 | |
| D. | 煤经过气化和液化两种物理变化,可变为清洁能源 |
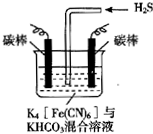 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- | |
| B. | 电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 |
| A. | 10g46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| B. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| C. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| D. | 24g3H218O含有的中子数为10NA |