题目内容
2.水是重要的自然资源.(1)湿衣服晾干体现了水分子的不断运动.
(2)日常生活中,常用煮沸的方法降低水的硬度.
(3)水可以配制各种溶液.将100g溶质质量分数为98%的浓硫酸配制成10%的稀硫酸,需水的质量为880 g.
分析 (1)依据分子式不断运动着的性质回答;
(2)硬水是指含有较多钙镁离子的水,依据饮用水的软化方法回答;
(3)依据溶液稀释过程中溶质的质量不变,设出未知数计算即可.
解答 解:(1)湿衣服晾干体现了水分子的不断,故答案为:运动;
(2)硬水是指含有较多钙镁离子的水,日常生活中硬水的常用软化方法为:煮沸,故答案为:煮沸;
(3)设需要水的质量为x,依据题意应有:100g×98%=(100g+x)×10%,解x=880g,故答案为:880.
点评 本题主要考查的是分子的性质、硬水定义以及其软化方法,溶液中溶质质量分数的有关计算等,难度不大.

练习册系列答案
相关题目
12.化学与生产,生活密切相关,下列有关说法中正确的是( )
| A. | 玻璃、水泥、水晶都是硅酸盐制品 | |
| B. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| C. | 石油的分馏和煤的气化、液化,涉及的都是物理变化 | |
| D. | 纤维素不能被人体消化吸收,但能促进肠道的蠕动,对人体有益 |
10.下列符号中,表示两个氢原子的是( )
| A. | H2 | B. | 2H | C. | 2H+ | D. | 2H2 |
17.亚硝酸钠(NaNO2)是一种常用的防腐剂,有咸味,易溶于水,有毒.在320℃时分解生成有刺激性气味的气体,与盐酸作用会放出红棕色气体.亚硝酸钠在食品中的添加量必须严格控制.下列说法不正确的是( )
| A. | 可用盐酸鉴别亚硝酸钠和食盐 | |
| B. | 亚硝酸钠可以加到食品中,但添加量要符合规定 | |
| C. | 亚硝酸钠受热分解放出的气体可能是NH3 | |
| D. | 亚硝酸钠由三种元素组成 |
11.下列有关说法错误的是( )
| A. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| B. | 等物质的量的NaClO、NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 0.01mol•L-1NaOH溶液与等体积pH=2的醋酸溶液混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 醋酸钠、盐酸两溶液混合后呈中性的溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
12.氨的合成是最重要的化工生产之一.
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
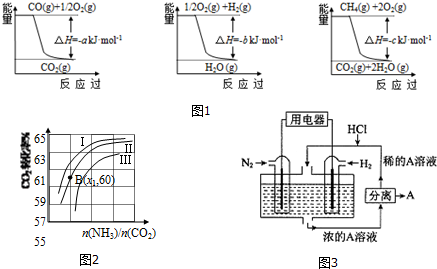
已知有关反应的能量变化如图1,且方法②的反应为吸热反应,则方法②中反应的△H=+(a+3b-c) kJ/moL.
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$ 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
(1)下列能说明该反应已达到平衡状态的是c
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min,表中c1>c2.(填“>”、“<”或“=”)
(3)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为30%,则x1=4.
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图3所示.
电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
已知有关反应的能量变化如图1,且方法②的反应为吸热反应,则方法②中反应的△H=+(a+3b-c) kJ/moL.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$ 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | c2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min,表中c1>c2.(填“>”、“<”或“=”)
(3)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为30%,则x1=4.
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图3所示.
电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.