题目内容
4.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,下列说法正确的是( )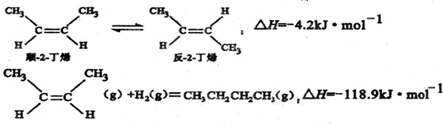
| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: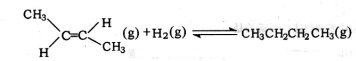 △H=-123.1kJ•mol-1 △H=-123.1kJ•mol-1 |
分析 A.能量越低越稳定;
B.若生成物相同,反应物的能量高,则放出的热量多;
C.生成正丁烷的反应为气体体积减小的放热反应;
D.盖斯定律指若一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同.
解答 解:A.顺-2-丁烯转化为反-2-丁烯放热,说明反-2-丁烯能量低,更稳定,故A正确;
B.等量的顺-2-丁烯具有更高的能量.所以顺-2-丁烯燃烧热更大,故B错误;
C.生成正丁烷的反应为气体体积减小的放热反应,所以减压向逆向移动,升温也向逆向移动,所以减压和升温不利于平衡向生成正丁烷反应方向移动,故C错误;
D.将下式-上式相加得到反-2-丁烯氢化的热化学方程式,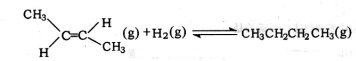 △H=-118.9kJ•mol-1-(-4.2kJ•mol-1)=-114.7kJ•mol-1,故D错误.
△H=-118.9kJ•mol-1-(-4.2kJ•mol-1)=-114.7kJ•mol-1,故D错误.
故选A.
点评 本题考查能量越低越稳定和盖斯定律、影响平衡的因素等,难度适中,注意掌握运用盖斯定律解题.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
14.为建设“蓝天常在、青山常在、绿水常在”的美丽中国,2015年4月16日国务院颁布了《水污染防治行动计划》.下列做法有利于该目标实现的是( )
| A. | 推广使用含磷洗涤剂 | B. | 用O3替代Cl2作饮用水消毒剂 | ||
| C. | 用工业污水直接灌溉农田 | D. | 含H2SO4的废水用BaCl2处理后排放 |
15.三种常见的酸(或碱)在水溶液中的电离情况如下表,下列说法正确的是
( )
| 温度/℃ | 化合物 | C/mol.L-1 | c(H+)/mol.L-1 | c(OH-)/mol.L-1 |
| 25 | HA | 1.0×10-2 | 1.0×10-2 | 1.0×10-12 |
| 25 | HB | 1.0×10-2 | 1.0×10-4 | 1.0×10-10 |
| 25 | MOH | 1.0×10-3 | 1.0×10-11 | 1.0×10-3 |
| 100 | MOH | 1.0×10-3 | 1.0×10-8 | 1.0×10-3 |
| A. | 温度相同,物质的量浓度也相同的MA和MB溶液,前者pH大于后者 | |
| B. | pH相同的HA和HB的溶液中c(A-)=c(B-) | |
| C. | 相同浓度的MOH溶液,溶液的碱性随温度的升高而减弱 | |
| D. | 25℃时MOH抑制水的电离,100℃时MOH促进水的电离 |
12.化学与生产,生活密切相关,下列有关说法中正确的是( )
| A. | 玻璃、水泥、水晶都是硅酸盐制品 | |
| B. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| C. | 石油的分馏和煤的气化、液化,涉及的都是物理变化 | |
| D. | 纤维素不能被人体消化吸收,但能促进肠道的蠕动,对人体有益 |
19.X、Y、Z、W、R均为第三周期主族元素,且原子序数依次增大.X、Y、W的最高价氧化物对应水化物两两之间都能发生反应,Z的单质具有半导体的特性,W原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | X与氧元素形成的化合物中可能含有共价键 | |
| B. | 第三周期元素的简单离子中Y离子的半径最小 | |
| C. | Z、W的氧化物均为酸性氧化物 | |
| D. | R元素含氧酸的酸性一定强于W |
9.氮及其化合物在工农业生产、生活中有重要作用.请按要求回答下列相关问题:
(1)食品添加剂铵明矾NH4Al(SO4)2•12H2O高温可分解,下列关于其分解产物的预测不合理的是C
A.NH3、N2、SO2、H2O
B.NH3、SO3、H2O
C.NH3、SO2、H2O
D.NH3、N2、SO3、SO2、H2O
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为图1: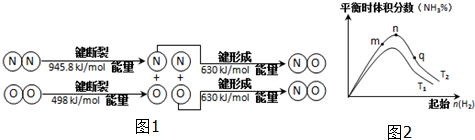
该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183.8kJ/mol.
(3)工业合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图2示:
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是p点.
②T2条件下,在2L的密闭容器中,充入x mol N2和y mol H2时,3min达平衡,此时反应物的转化率均为a,
写出下列仅含a、x的表达式(不必化简):
v(N2)=$\frac{xa}{6}$mol•L-1•min-1;该反应的平衡常数的值K=$\frac{16(xa)^{2}}{(x-xa)(3x-3xa)^{3}}$.
③图象中T2低于T1(填“高于”、“低于”、“等于”或“无法确定”).
④科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,这提高了氮气和氢气的转化率.写出电化学合成过程中发生还原反应的电极方程式:N2+6H++6e-=2NH3.
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
下列有关分析推断正确的是AC.
A.硝酸起始浓度为4mol/L
B.①中溶解了5.6g Fe
C.③中n(Cu2+)=0.15mol
D.④中V=6.72L.
(1)食品添加剂铵明矾NH4Al(SO4)2•12H2O高温可分解,下列关于其分解产物的预测不合理的是C
A.NH3、N2、SO2、H2O
B.NH3、SO3、H2O
C.NH3、SO2、H2O
D.NH3、N2、SO3、SO2、H2O
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为图1:

该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183.8kJ/mol.
(3)工业合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图2示:
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是p点.
②T2条件下,在2L的密闭容器中,充入x mol N2和y mol H2时,3min达平衡,此时反应物的转化率均为a,
写出下列仅含a、x的表达式(不必化简):
v(N2)=$\frac{xa}{6}$mol•L-1•min-1;该反应的平衡常数的值K=$\frac{16(xa)^{2}}{(x-xa)(3x-3xa)^{3}}$.
③图象中T2低于T1(填“高于”、“低于”、“等于”或“无法确定”).
④科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,这提高了氮气和氢气的转化率.写出电化学合成过程中发生还原反应的电极方程式:N2+6H++6e-=2NH3.
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |
A.硝酸起始浓度为4mol/L
B.①中溶解了5.6g Fe
C.③中n(Cu2+)=0.15mol
D.④中V=6.72L.
16.乙烷与氯气在光照条件下发生取代反应所得有机物数目共有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |