题目内容
5.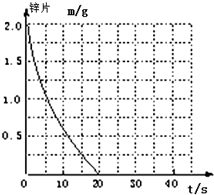 兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.
兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.(1)酸液都取足量、相同体积,请你帮助完成以下面实验设计表(表中不要留空格):
| 实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
| ① | 298 | 0.20mol/L | / | a.实验①和②是探究不同温度对锌与盐酸反应速率的影响; b.实验①和③是探究不同浓度对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与锌反应速率的区别. |
| ② | 308 | 0.20mol/L | / | |
| ③ | 298 | 0.40mol/L | / | |
| ④ | 298 | / | 0.20 |
(3)某实验小组在做(1)中实验④时误加少量0.10mol/L CuCl2溶液,发现反应速率与(1)中实验①接近.该组同学对影响因素提出如下假设,请完成假设三:
假设一:Cu2+对该反应起催化剂作用
假设二:Cl-对该反应起催化剂作用
假设三:形成Zn-Cu原电池,加快反应速率(其它答案合理亦可)
…
(4)请你设计实验验证上述假设三是否成立,写出实验步骤及预期现象:
| 实验步骤 | 预期现象 |
| ①将不连接的铜、锌电极插入稀硫酸中,②将铜、锌电极用导线连接放入稀硫酸中 | 产生氢气的速率②大于①,证明构成原电池后可以大大加快反应速率 |
分析 (1)根据实验①和②的不同点、实验①和③的不同点确定哪种因素对反应速率的影响,实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与Zn反应速率的区别,因此其它量不变,只把盐酸换成醋酸即可;
(2)根据浓度、温度对反应速率的影响,可通过反应的时间体现;
(3)锌能够将铜离子还原生成铜,铜与锌构成原电池,加快了反应速率,据此判断假设3;
(4)设计对照试验,其中一个为原电池即可.
解答 解:(1)实验①和②的不同点是盐酸的温度,所以是探究不同温度对Zn与盐酸反应速率的影响,实验①和③的不同点是盐酸的浓度,所以是探究不同浓度对Zn与盐酸反应速率的影响,实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与锌反应速率的区别,所以实验④的温度是298K,醋酸的浓度是0.20mol/L,
故答案为:④:298;0.20;实验目的:a.不同温度;b.不同浓度;
(2)该反应温度每升高10℃,反应速率是原来的2倍,温度相同、浓度相同时,醋酸的平均反应速度是盐酸的$\frac{1}{2}$,与①比较,②温度升高10℃,反应速率是原来的2倍,所以②反应时间缩短到10s;④的反应速率是①的$\frac{1}{2}$,则反应时间是①的2倍,即20s×2=40s,据此画出图象为: ;
;
故答案为: ;
;
(3)Zn置换出Cu,构成Zn-Cu原电池,能够加快反应速率,所以假设3为:形成Zn-Cu原电池,加快反应速率,
故答案为:形成Zn-Cu原电池,加快反应速率(其它答案合理亦可);
(4)设计对照试验,其中一个为原电池,如:①将不连接的铜、锌电极插入稀硫酸中,会过程中铜电极不反应,锌电极产生氢气;
②将铜、锌电极用导线连接放入稀硫酸中,可以观察到在铜电极上迅速产生氢气,产生氢气的速率大于①,根据①②可知,Zn-Cu构成原电池后可以大大加快反应速率,
故答案为:①将不连接的铜、锌电极插入稀硫酸中,②将铜、锌电极用导线连接放入稀硫酸中;产生氢气的速率②大于①,证明构成原电池后可以大大加快反应速率.
点评 本题考查外界条件对化学反应速率的影响,注意掌握影响化学反应速率的因素,明确探究外界条件对反应速率的影响时,必须是只有一个条件不同,其它条件相同时,才能比较得出结论,否则不能得出正确结论.

 名校课堂系列答案
名校课堂系列答案| 温度/℃ | 化合物 | C/mol.L-1 | c(H+)/mol.L-1 | c(OH-)/mol.L-1 |
| 25 | HA | 1.0×10-2 | 1.0×10-2 | 1.0×10-12 |
| 25 | HB | 1.0×10-2 | 1.0×10-4 | 1.0×10-10 |
| 25 | MOH | 1.0×10-3 | 1.0×10-11 | 1.0×10-3 |
| 100 | MOH | 1.0×10-3 | 1.0×10-8 | 1.0×10-3 |
| A. | 温度相同,物质的量浓度也相同的MA和MB溶液,前者pH大于后者 | |
| B. | pH相同的HA和HB的溶液中c(A-)=c(B-) | |
| C. | 相同浓度的MOH溶液,溶液的碱性随温度的升高而减弱 | |
| D. | 25℃时MOH抑制水的电离,100℃时MOH促进水的电离 |
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
| A. | H2 | B. | 2H | C. | 2H+ | D. | 2H2 |
| A. | 可用盐酸鉴别亚硝酸钠和食盐 | |
| B. | 亚硝酸钠可以加到食品中,但添加量要符合规定 | |
| C. | 亚硝酸钠受热分解放出的气体可能是NH3 | |
| D. | 亚硝酸钠由三种元素组成 |
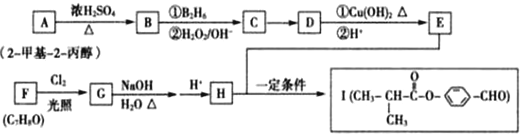
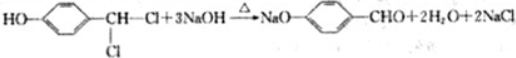 .
.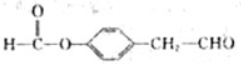 、
、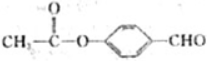 .
.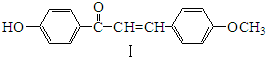

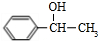 ,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为
,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为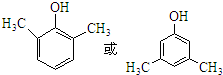 (任写一种).
(任写一种).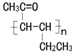 是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为
是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为 ,
, ,
, .
.