题目内容
3.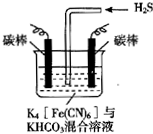 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- | |
| B. | 电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 |
分析 A、电解时阳极发生失电子的氧化反应,先将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;
B、阴极发生还原反应,电解质溶液中的阴极离子碳酸氢根离子,电离产生氢离子在阴极放电;
C、根据2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S和阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,得到关系式为:H2↑~2CO32-~S根据计算求解;
D、因后来发生反应为2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,所以整个过程中不需要不断补充硫化氢.
解答 解:A、电解时阳极发生失电子的氧化反应,先将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高,所以反应为:[Fe(CN)6]4--e-═[Fe(CN)6]3-,故A正确;
B、电解质溶液中的阴极离子碳酸氢根离子,电离产生氢离子在阴极放电,所以电极反应式为2HCO3-+2 e-═H2↑+2CO32-,故B正确;
C、根据2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S和阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,得到关系式为:H2↑~2CO32-~S,所以22.4L标准状况下的H2生成时,溶液中有32gS析出,故C正确;
D、因后来发生反应为2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,所以整个过程中需要不断补充硫化氢,故D错误;
故选D.
点评 本题主要考查了利用电解原理来判断电极方程式、转移电子数等,难度不大,抓住电解的原理分析阴阳极的反应是解题的根本.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列有关说法错误的是( )
| A. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| B. | 等物质的量的NaClO、NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 0.01mol•L-1NaOH溶液与等体积pH=2的醋酸溶液混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 醋酸钠、盐酸两溶液混合后呈中性的溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
18.化学与科技、生产、生活密切相关.下列说法正确的是( )
| A. | 气象环境报告中的“PM2.5”是一种新分子的描述 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量、 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 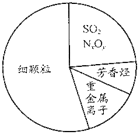 如图为雾霾的主要成分示意图,SO2和NxOy都属于酸性氧化物 |
8.某溶液中含有NH4+,Fe2+,Al3+,SO42-,Cl-五种离子,若向其中加入过量的Na2O2,微热并搅拌,再通入过量的HI气体,充分反应后,最后加入足量稀硝酸酸化的硝酸钡溶液,则下列叙述不正确的是( )
| A. | Al3+先形成沉淀后溶解,后来再形成沉淀接着又沉淀溶解 | |
| B. | 反应后,溶液中NH4+,Fe2+,SO42-的物质的量减少,而Al3+、Cl-的物质的量不变 | |
| C. | Fe2+先被氧化并形成沉淀,后来沉淀溶解并被还原为Fe2+,最后又被氧化 | |
| D. | 该实验中共有两种气体生成 |
12.氨的合成是最重要的化工生产之一.
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
已知有关反应的能量变化如图1,且方法②的反应为吸热反应,则方法②中反应的△H=+(a+3b-c) kJ/moL.
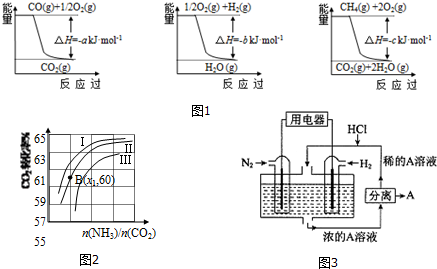
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$ 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
(1)下列能说明该反应已达到平衡状态的是c
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min,表中c1>c2.(填“>”、“<”或“=”)
(3)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为30%,则x1=4.
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图3所示.
电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
已知有关反应的能量变化如图1,且方法②的反应为吸热反应,则方法②中反应的△H=+(a+3b-c) kJ/moL.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$ 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | c2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min,表中c1>c2.(填“>”、“<”或“=”)
(3)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为30%,则x1=4.
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图3所示.
电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
13.短周期主族元素X、Y、Z的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物.常温下,Z的单质能溶于X的最高价氧化物水化物的稀溶液,不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Y的最高正化合价为+6 | B. | 简单离子半径的大小顺序:X>Y>Z | ||
| C. | 简单气态氢化物的稳定性:X>Y | D. | 元素X和Y能形成离子化合物 |
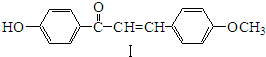

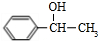 ,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为
,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为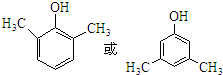 (任写一种).
(任写一种).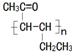 是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为
是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为 ,
,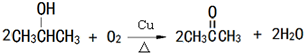 ,
, .
.