题目内容
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 10g46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| B. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| C. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| D. | 24g3H218O含有的中子数为10NA |
分析 A、乙醇水溶液中溶剂水中含有氢原子,依据乙醇和溶剂水中所含氢原子计算判断;
B、氯气溶于水,只有部分氯气与水反应生成氯化氢和次氯酸,无法计算转移的电子数;
C、根据阳极Cu-2e═Cu2+,电解精炼铜是阳极为粗铜来分析;
D、依据n=$\frac{m}{M}$计算物质的量,结合质量数=质子数+中子数计算;
解答 解:A、10g46%的乙醇水溶液中所含氢原子数目=($\frac{10g×46%}{46g/mol}×6+\frac{10g×54%}{18g/mol}×2$)×NA=1.2NA,故A正确;
B、标准状况下,2.24L氯气的物质的量为0.1mol,由于氯气溶于水后,只有少量的氯气与水反应,反应是可逆反应,转移的电子数目小于0.1NA,无法计算转移的电子的物质的量,故B错误;
C、由Cu-2e═Cu2+,每转移NA个电子时,阳极溶解铜的质量为0.5mol×64g/mol=32g,但阳极材料为粗铜,则阳极溶解铜的质量小于32g,故C错误;
D、24g3H218O物质的量=$\frac{24g}{24g/mol}$=1mol,中子数=1mol[2×(3-1)+18-8]×NA=14NA,故D错误;
故选A.
点评 本题考查有关物质的量及阿伏伽德罗常数的计算,明确电子数等于质子数、质量数=质子数+中子数、电极反应式及电极材料是解答的关键,并注意可逆反应不能进行彻底来解答,题目难度中等.

练习册系列答案
相关题目
12.氨的合成是最重要的化工生产之一.
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
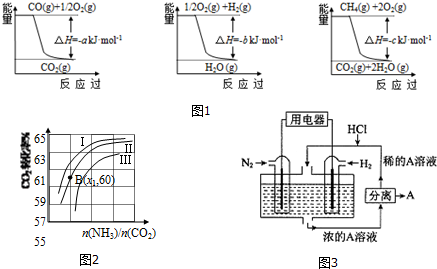
已知有关反应的能量变化如图1,且方法②的反应为吸热反应,则方法②中反应的△H=+(a+3b-c) kJ/moL.
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$ 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
(1)下列能说明该反应已达到平衡状态的是c
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min,表中c1>c2.(填“>”、“<”或“=”)
(3)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为30%,则x1=4.
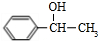
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图3所示.
电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
已知有关反应的能量变化如图1,且方法②的反应为吸热反应,则方法②中反应的△H=+(a+3b-c) kJ/moL.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$ 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | c2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min,表中c1>c2.(填“>”、“<”或“=”)
(3)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为30%,则x1=4.
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图3所示.
电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
16.下列离子方程式与实验事实相符且正确的是( )
| A. | 向AgI浊液中滴入NaCl溶液,产生大量白色沉淀:AgI(s)+Cl-(aq)=AgCl(s)+I-(aq) | |
| B. | 用氨水除去铝片表面的氧化膜:Al2O3+2NH3•H2O=2AlO2-+2NH4++H2O | |
| C. | 用铁氰化钾溶液检验Fe2+:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ | |
| D. | 向酸性KMnO4溶液中滴入过氧化氢产生无色气泡:2MnO4-+9H2O2+6H+=2Mn2++7O2↑+12H2O |
13.短周期主族元素X、Y、Z的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物.常温下,Z的单质能溶于X的最高价氧化物水化物的稀溶液,不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Y的最高正化合价为+6 | B. | 简单离子半径的大小顺序:X>Y>Z | ||
| C. | 简单气态氢化物的稳定性:X>Y | D. | 元素X和Y能形成离子化合物 |
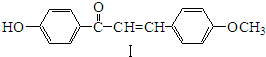

 ,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为
,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1:1:2:6,则V的结构简式为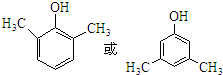 (任写一种).
(任写一种).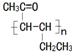 是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为
是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体.合成过程中涉及的反应方程式为 ,
,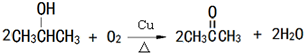 ,
, .
. 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.