题目内容
10.某同学为了比较碳元素和硅元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).请回答: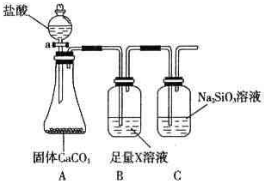
(1)为吸收CO2中混有的HCl气体,B装置中的X是NaHCO3溶液(填化学式).
(2)能说明碳元素和硅元素非金属性强弱的实验现象是产生白色沉淀,反应的化学方程式是CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3
(3)同主族原色从上到下原子半径逐渐增大,得电子能力逐渐减弱非金属性逐渐减弱
(4)比较甲,乙两种元素金属性的相对强弱,下列事实不能说明甲的金属性比乙强的是C
A.甲与水反应比乙与水反应剧烈
B.甲单质能从乙的盐溶液中置换出单质乙
C.某非金属反应时甲原子失去电子数目比乙的多.
分析 (1)二氧化碳在饱和碳酸氢钠溶液中溶解度小,且碳酸氢钠能够与盐酸反应生成氯化钠和二氧化碳、水;
(2)碳酸酸性强于硅酸,硅酸为不溶性沉淀;
(3)同主族元素从上到下,电子层逐渐增多,原子核对最外层电子吸引力逐渐减弱;
(4)比较元素的金属性,可通过①最高价氧化物的水化物的碱性强弱;②与水或酸反应的剧烈程度;③金属之间的置换反应;④构成原电池的正负极等角度比较.
解答 解:(1)二氧化碳在饱和碳酸氢钠溶液中溶解度小,且碳酸氢钠能够与盐酸反应生成氯化钠和二氧化碳、水,所以可以用盛有饱和碳酸氢钠溶液的除去二氧化碳中的氯化氢,
故答案为:NaHCO3;
(2)C中盛装硅酸钠溶液,由于碳酸酸性比硅酸强,在C中通入二氧化碳气体生成硅酸沉淀,反应的离子方程式为CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,产生白色沉淀;
故答案为:产生白色沉淀;CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3;
(3)同主族元素从上到下,电子层逐渐增多,原子半径逐渐增大,原子核对最外层电子吸引力逐渐减弱,得电子能力逐渐减弱,非金属性逐渐减弱;
故答案为:增大;减弱;减弱;
(4)A.甲与水反应比乙与水反应剧烈,金属性越强,与水反应越剧烈,故能说明甲的金属性比乙强,故A正确;
B.甲单质能从乙的盐溶液中置换出单质乙,还原性甲>乙,故甲更活泼,金属性更强,故B正确;
C.金属性的强弱与失去电子的难易有关,与失去电子的多少无关,如相同物质的量的Al、Na与氯气反应,Al失去电子数目较多,但Na的金属性强,故C错误;
故选:C.
点评 本题考查了元素性质强弱比较,熟悉元素金属性、非金属性强弱判断依据是解题关键,题目难度不大.

练习册系列答案
相关题目
1.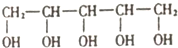 木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )
木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )
 木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )
木糖醇原产于芬兰,是一种天热、健康的甜味剂,入口后往往伴有微微的清凉感,防龋齿,适合糖尿病患者的需要.它的结构简式如图.下列有关木糖醇的叙述错误的是( )| A. | 木糖醇易溶于水,溶解过程的△H>0 | |
| B. | 一定条件下,木糖醇能与HCl反应,也能与醋酸反应,属于同一反应类型 | |
| C. | 木糖醇是一种单糖,不能发生水解反应 | |
| D. | 1mol木糖醇与足量的钠反应最多可产生2.5molH2 |
18.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,下列说法不正确的是( )
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素最高价氧化物对应水化物的酸性一定强于Y | |
| C. | X与Y元素形成的两种常见化合物分别溶于水后溶液PH<7 | |
| D. | Z元素单质在化学反应中只表现氧化性 |
5.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol FeCl3完全转化为Fe(OH)3胶体后形成NA个胶粒 | |
| B. | 1 L 0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1 NA | |
| C. | 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为NA | |
| D. | 0.2 mol乙炔和乙醛混合气体在氧气中完全燃烧,消耗氧气的分子数为0.5NA |
10. 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:
(1)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-) B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-) D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O又知该反应开始时速率较慢,随后大大加快,可能的原因是生成的Mn2+对该反应具有催化作用
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2ml0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-) B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-) D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O又知该反应开始时速率较慢,随后大大加快,可能的原因是生成的Mn2+对该反应具有催化作用
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2ml0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
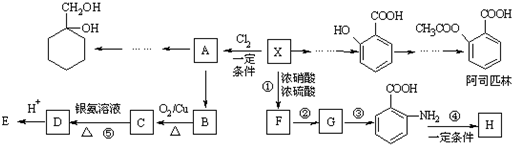
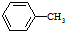 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$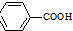
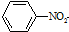 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$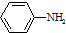 (苯胺,易被氧化)
(苯胺,易被氧化)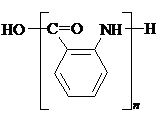 或
或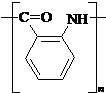 ;
; ;
;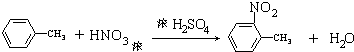 ;
;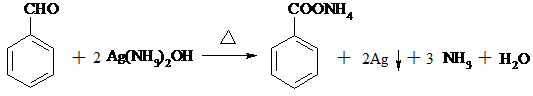 ;
;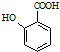 有多种同分异构体,写出2种含有1个醛基和2个羟基的芳香族化合物的结构简式:
有多种同分异构体,写出2种含有1个醛基和2个羟基的芳香族化合物的结构简式: ;
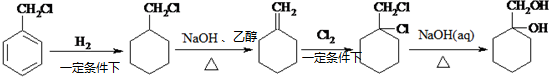
;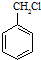 和其他无机物合成
和其他无机物合成 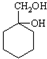 最合理的方案(不超过4步).
最合理的方案(不超过4步).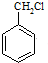 $→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$
$→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$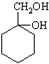
 .
.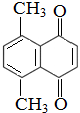
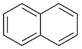 )的衍生物,且与A互为同分异构体.
)的衍生物,且与A互为同分异构体.