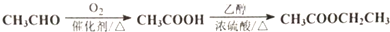题目内容
5.NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 1mol FeCl3完全转化为Fe(OH)3胶体后形成NA个胶粒 | |
| B. | 1 L 0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1 NA | |
| C. | 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为NA | |
| D. | 0.2 mol乙炔和乙醛混合气体在氧气中完全燃烧,消耗氧气的分子数为0.5NA |
分析 A、FeCl3水解是可逆反应,1mol FeCl3完全转化为Fe(OH)3胶体后形成胶粒小于NA;
B、溶液中存在物料守恒,碳原子守恒;
C、A、由2NO+O2═2NO2,2NO2?N2O4,利用气体的物质的量来分析分子总数;
D、先分析乙炔和乙醛的分子式,乙醛燃烧需要氧气的量与相同物质的量的乙炔燃烧需要氧气的量相同,所以乙炔和乙醛都可以认为是乙炔,然后根据乙炔燃烧的方程式计算需要氧气的物质的量.
解答 解:A、FeCl3水解是可逆反应,1mol FeCl3完全转化为Fe(OH)3胶体后形成胶粒小于NA,故A错误;
B、1 L 0.1 mol/L Na2CO3溶液中H2CO3、CO32-和HCO3-总数为0.1 NA,故B错误;
C、A、标准状况下,22.4LNO和11.2L氧气的物质的量分别为1mol、0.5mol,由2NO+O2═2NO2,2NO2?N2O4,则气体的分子总数小于NA个,故C错误;
D、乙炔的分子式是C2H2,乙醛的分子式是C2H4O,乙醛的分子式可认为C2H2.H2O,乙炔和乙醛燃烧时需要氧气的量,可以认为都是乙炔燃烧需要的氧气量,
2 C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+4CO2,
2mol 5NA
0.4mol NA
所以0.4 mol乙炔和乙醛混合气体,在氧气中充分燃烧,消耗氧气的分子数为NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,注意电解质溶液中物料守恒分析,气体摩尔体积的条件应用,胶体组成,一氧化氮和氧气反应生成的二氧化氮可以聚合为四氧化二氮,题目难度中等.

练习册系列答案
相关题目
5.如表是元素周期表的一部分,针对表中的①-⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填元素符号).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: .
.
(3)最高价氧化物是两性氧化物的元素是Al(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程 .
.
| 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)最高价氧化物是两性氧化物的元素是Al(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程
 .
.
3.分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法.下列(2)中的物质并不能按照对应的分类标准与(1)中的物质归为一类的是( )
| 选项 | (1) | (2) | 分类标准 |
| A | 盐酸、漂白粉、水玻璃、双氧水 | 氨水 | 混合物 |
| B | CH3COOH,H2CO3、HClO、NH3•H2O | HF | 弱电解质 |
| C | 电解反应、盐的水解、煤的干馏、石油裂化 | 钢铁生锈 | 化学变化 |
| D | CO2、SO3、P2O5、SiO2 | Al2O3 | 酸性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
10.设阿伏加德罗常数的值为NA,下列说法正确的是( )
| A. | 1 mol硫酸钾中阴离子所带电荷数为NA | |
| B. | 标准状况下,分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28 g | |
| C. | 铝跟氢氧化钠溶液反应,生成3.36 L H2,转移的电子数为0.3 NA | |
| D. | 50 mL 8 mol/L的浓盐酸与足量的MnO2加热反应,生成Cl2的分子数为0.1NA |
17.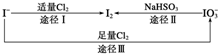 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:
(1)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示.
下列说法中不正确的是C
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O═2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D.途径Ⅱ中若生成1mol I2,则反应中转移的电子数为10NA
(2)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+I-(aq)═I3-(aq) …①
I2(aq)+2I-(aq)═I42-(aq) …②
则反应②的平衡常数表达式,K=$\frac{c({I}_{4}^{2-})}{c({I}_{2}){c}^{2}({I}^{-})}$.
I2的起始浓度均为0.1mol•L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
根据表中数据,可得出的两条结论是①条件相同时,I3-离子的物质的量分数组成始终占绝对优势(或I3-含量高,I42-含量低)、②?随I-离子浓度的增加,I3-离子的物质的量分数降低,I42-离子的物质的量分数增加.;
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉作指示剂作滴定指示荆,滴定终点的现象是溶液由蓝色变为无色且半分钟内不恢复为蓝色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2..
③该试样中CuCl2•2H2O的质量百分数为95%.
 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:(1)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示.
下列说法中不正确的是C
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O═2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D.途径Ⅱ中若生成1mol I2,则反应中转移的电子数为10NA
(2)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+I-(aq)═I3-(aq) …①
I2(aq)+2I-(aq)═I42-(aq) …②
则反应②的平衡常数表达式,K=$\frac{c({I}_{4}^{2-})}{c({I}_{2}){c}^{2}({I}^{-})}$.
I2的起始浓度均为0.1mol•L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
| KI起始浓度/mol•L-1 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 |
| I3-% | 88.98 | 88.04 | 85.28 | 82.26 | 79.23 |
| I42-% | 4.38 | 8.67 | 12.60 | 16.21 | 19.53 |
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉作指示剂作滴定指示荆,滴定终点的现象是溶液由蓝色变为无色且半分钟内不恢复为蓝色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2..
③该试样中CuCl2•2H2O的质量百分数为95%.
14.下列说法中,错误的是( )
| A. | 酸碱中和反应属放热反应 | |
| B. | 化学变化中的能量变化主要由化学键变化引起的 | |
| C. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| D. | 相同条件下,1mol石墨转化为金刚石要吸收1.895kJ热量,说明金刚石比石墨稳定 |
15.下列关于氯化铵溶液的说法正确的是( )
| A. | 升高温度,氯化铵水解程度增大 | |
| B. | 水解平衡向右移动,溶液的pH一定减小 | |
| C. | 向溶液中加入氯化钠固体,能抑制氯化铵的电离 | |
| D. | 向溶液中加入氯化铵固体,水解平衡向右移动,水解程度增大 |
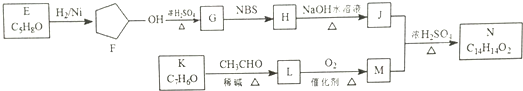
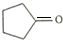 .
. .
.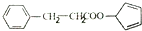 ,请再写出三种五元环上不是含一个双键的同分异构体:
,请再写出三种五元环上不是含一个双键的同分异构体: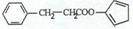 、
、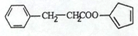 、
、 .
.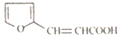 )是一种医治血吸虫病的药呋喃丙胺的原料.请以
)是一种医治血吸虫病的药呋喃丙胺的原料.请以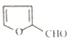 、CH3CH2OH为有机原料合成呋喃.(无机试剂及溶剂任选)
、CH3CH2OH为有机原料合成呋喃.(无机试剂及溶剂任选)