题目内容
10. 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-) B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-) D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O又知该反应开始时速率较慢,随后大大加快,可能的原因是生成的Mn2+对该反应具有催化作用
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2ml0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
分析 (1)常温下0.01mol/L的H2C2O4pH为2.1,KHC2O4,的pH为3.1,说明草酸是二元弱酸;
(2)HC2O4-既能够电离也能够水解,KHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度;
A.根据物料守恒判断;
B.根据电荷守恒判断;
C.根据物料守恒、电荷守恒判断;
D.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些;
(3)草酸和高锰酸钾溶液反应在酸性溶液中 发生氧化还原反应,草酸被氧化为二氧化碳,高锰酸钾被还原为锰离子;反应开始时速率较慢,随后大大加快,说明生成的Mn2+对该反应具有催化作用;
(4)两烧杯中水的温度不同,该实验是研究温度对反应速率的影响;草酸与高锰酸钾反应的物质的量之比为5:2,据此分析.
解答 解:(1)二元弱酸分步电离,草酸电离方程式为:H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-,
故答案为:H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-;
(2)HC2O4-既能够电离也能够水解,KHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度;
A.碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根据物料守恒有c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),故A正确;
B.根据电荷守恒有:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),故c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-),故B错误;
C.由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)、c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)可知,c(Na+)=c(C2O42-)-c(H2C2O4),故C错误;
D.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些,故c(K+)>c(Na+),故D正确;
故答案为:HC2O4-的电离程度大于水解程度;AD;
(3)草酸和高锰酸钾溶液反应在酸性溶液中 发生氧化还原反应,草酸被氧化为二氧化碳,高锰酸钾被还原为锰离子,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,反应开始时速率较慢,随后大大加快,说明生成的Mn2+对该反应具有催化作用,
故答案为:2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O;反应生成的Mn2+对该反应具有催化作用;
(4)两烧杯中水的温度不同,该实验是研究温度对反应速率的影响;草酸与高锰酸钾反应的物质的量之比为5:2,试管中草酸与高锰酸钾物质的量之比为1:2,高锰酸钾过量,不能完全反应,所以不褪色,
故答案为:温度对反应速率的影响;KMnO4溶液过量.
点评 本题考查弱电解质的电离平衡及其应用,题目难度中等,涉及草酸的电离方程式书写、电解质溶液中的电荷守恒和物料守恒、草酸的还原性以及影响化学反应速率的因素的探究,试题培养了学生的分析能力及灵活应用能力.

 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 .
.(2)②、③、⑤元素的原子半径由大到小的顺序为Na>C>N.
(3)②、④、⑦元素的气态氢化物稳定性由强到弱的顺序是H2O>CH4>SiH4.
(4)有两种化合物A和B都由①④⑤⑧四种元素组成.若A与B在水溶液中能发生离子反应,则该反应的离子方程式为H++HSO3-=H2O+SO2↑.
(5)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.
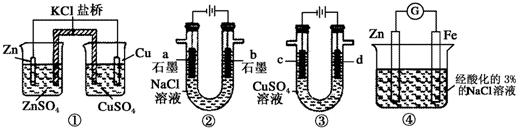
| A. | 装置①中,一段时间后SO42-浓度增大 | |
| B. | 装置②中滴入酚酞,a极附近变红 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④中发生吸氧腐蚀 |
| A. | 升高温度,氯化铵水解程度增大 | |
| B. | 水解平衡向右移动,溶液的pH一定减小 | |
| C. | 向溶液中加入氯化钠固体,能抑制氯化铵的电离 | |
| D. | 向溶液中加入氯化铵固体,水解平衡向右移动,水解程度增大 |
| A. | 共价化合物:是否含有共价键 | |
| B. | 氧化还原反应:元素化合价是否变化 | |
| C. | 强弱电解质:溶液的导电能力大小 | |
| D. | 溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
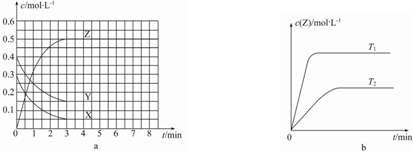
| A. | 该反应的正反应是放热反应 | |
| B. | 若在第6 min时升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 图a中反应达到平衡时,Y的转化率为37.5% | |
| D. | 反应中某时刻各物质的正反应速率为2v(X)═2v(Y)═v(Z) |
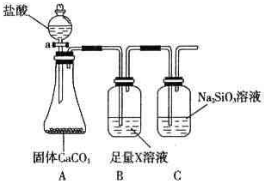

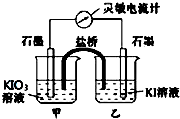 将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池.
将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池.