题目内容
5.SO2、CO、氮氧化物和可吸入颗粒物都是大气污染物.(1)比较N、O的第一电离能大小关系为N>O(填“>”、“<”或“=”).
(2)CO易与血红蛋白中Fe2+结合稳定的配合物而使人中毒.写出Fe基态原子的价电子排布式3d64s2;CO有多种等电子体,写出其中一种N2、CN-、C22-等.
(3)为减轻SO2污染,火力发电厂常在燃煤汇总加入CaO“固硫”,CaO和NaCl晶胞结构类型相同,则每个Ca2+周围与它最近且等距的Ca2+有12个;CaO晶体的熔点高于NaCl晶体,说明两者晶格能CaO大于NaCl(填“大于”或“小于”).
分析 (1)元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(2)Fe是26号元素,其原子核外有26个电子,3d、4s电子为其价电子,根据构造原理书写其核外电子排布式;原子个数相等、价电子数相等的微粒为等电子体;
(3)CaO和NaCl晶胞结构类型相同,则每个Ca2+周围与它最近且等距的Ca2+个数=3×8÷2;离子晶体晶格能与离子电荷成正比、与离子半径成反比.
解答 解:(1)元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能N>O,故答案为:>;
(2)Fe是26号元素,其原子核外有26个电子,3d、4s电子为其价电子,根据构造原理书写Fe核外电子排布式为3d64s2;原子个数相等、价电子数相等的微粒为等电子体,与CO等电子体的微粒有N2、CN-、C22-等;
故答案为:3d64s2;N2、CN-、C22-等;
(3)CaO和NaCl晶胞结构类型相同,则每个Ca2+周围与它最近且等距的Ca2+个数=3×8÷2=12;离子晶体晶格能与离子电荷成正比、与离子半径成反比,CaO中离子电荷大于NaCl,所以晶格能CaO大于NaCl,
故答案为:12;大于.
点评 本题考查物质结构和性质,涉及晶胞计算、晶格能、原子核外电子排布、第一电离能等知识点,综合性较强,难点是配位数的计算,注意第一电离能的规律和异常现象,题目难度不大.

练习册系列答案
相关题目
15.下列分值中,所有原子的最外层均满足8电子稳定结构的是( )
| A. | PCl5 | B. | N2 | C. | BF3 | D. | H2O |
16.下列表示对应化学反应的离子式方程式正确的是( )
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32- | |
| B. | 漂白粉溶液中通入过量CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | |
| C. | 向NH4Al(SO4)2溶液中逐渐滴入加入Ba(OH)2溶液恰好使SO42-反应完全: 2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| D. | FeBr2溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
20.在溶液中能大量共存的微粒组是( )
| A. | K+、CH3COOH、CO32-、NO3- | B. | Fe3+、Na+、SCN-、Cl- | ||
| C. | Ba2+、Na+、OH-、HCO3- | D. | H+、K+、Fe3+、NO3- |
7.设阿佛加德罗常数为NA,下列叙述正确的是( )
| A. | 1摩尔H2O所含质子数为12NA | |
| B. | 2克氢气所含原子数为NA | |
| C. | 0.5摩尔单质铝与足量盐酸反应转移电子数为1.5NA | |
| D. | 标准状况下,1升水所含分子数为$\frac{1}{22.4}$ NA |
5.关于下列装置说法正确的是( )
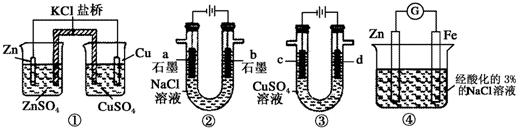

| A. | 装置①中,一段时间后SO42-浓度增大 | |
| B. | 装置②中滴入酚酞,a极附近变红 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④中发生吸氧腐蚀 |
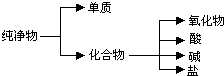 (1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)
(1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)