题目内容
7.已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol
②

下列说正确的是( )
| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H一O键比H一N键弱 |
分析 A.氧气中为O=O键,氮气中为N≡N键;
B.已知4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol,根据焓变=反应物断键吸收热量-生成物形成化学键放出热量判断,H-O键与H-N的键能大小;
C.键能与沸点无关;
D.元素的非金属性越强,与H元素形成的化学键越稳定.
解答 解:A.根据II可知O=O键的键能比N≡N键的键能小,则断开1molO=O键比断开1mol N≡N键所需能量少448kJ,故A错误;
B.已知4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol,则12H-N+3×498kJ/mol-2×946kJ/mol-12H-O=-1269kJ/mol,得(H-O)-(H-N)=72.6kJ/mol,所以断开1mol H-O键与断开1mol H-N键所需能量相差约72.6kJ,故B正确;
C.键能与沸点无关,沸点与分子间作用力有关,故C错误;
D.元素的非金属性越强,与H元素形成的化学键越稳定,非金属性:O>N,则H-O键比H-N键强,故D错误;
故选B.
点评 本题考查了化学键键能和焓变关系计算,图象分析判断,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
15.下列离子方程式的书写正确的是( )
| A. | 铁和稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 向硫酸钠溶液中滴加氯化钡溶液 Ba2++SO42-═BaSO4↓ | |
| C. | 氯水加入到溴化钾溶液中 Br-+Cl2═Br2+Cl- | |
| D. | 碳酸钙溶于稀盐酸 CO32-+2H+═H2O+CO2↑ |
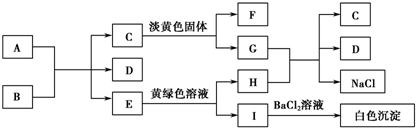
 .
. 日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下:
日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下: 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题: .
. 人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为:
人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为: .
.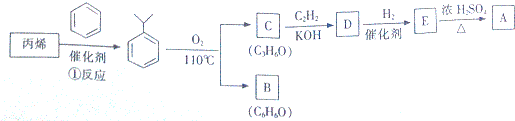
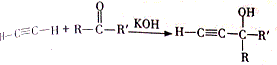
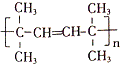 ,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.
,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.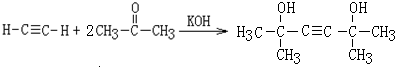 .
.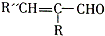 +H2O
+H2O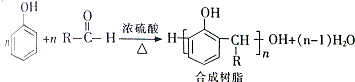
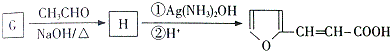
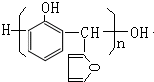 .
.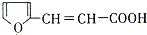 的所有同分异构体的结构简式
的所有同分异构体的结构简式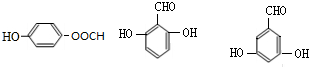 .
.