题目内容
15.下列离子方程式的书写正确的是( )| A. | 铁和稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 向硫酸钠溶液中滴加氯化钡溶液 Ba2++SO42-═BaSO4↓ | |
| C. | 氯水加入到溴化钾溶液中 Br-+Cl2═Br2+Cl- | |
| D. | 碳酸钙溶于稀盐酸 CO32-+2H+═H2O+CO2↑ |
分析 A.反应生成硫酸亚铁和氢气;
B.反应生成硫酸钡和氯化钠;
C.反应生成KCl和溴,电子不守恒;
D.碳酸钙在离子反应中保留化学式.
解答 解:A.铁和稀硫酸反应的离子反应为Fe+2H+═Fe2++H2↑,故A错误;
B.向硫酸钠溶液中滴加氯化钡溶液的离子反应为Ba2++SO42-═BaSO4↓,故B正确;
C.氯水加入到溴化钾溶液中的离子反应为2Br-+Cl2═Br2+2Cl-,故C错误;
D.碳酸钙溶于稀盐酸的离子反应为CaCO3+2H+═H2O+CO2↑+Ca2+,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
5.下列化合物中既存在离子键,又存在非极性键的是( )
| A. | H2O | B. | NH4Cl | C. | NaOH | D. | Na2O2 |
6.硫酸锰是工业上制备二氧化锰活性电极的原料,用软锰矿浊液吸收空气中的SO2,得到的硫酸锰溶液中含有CuSO4、Fe2(SO4)3杂质,向溶液中加入MnCO3,充分反应过滤;再加入MnS,充分反应后过滤,可以得到碱性的硫酸锰溶液.已知常温下,Ksp[Fe(OH)3]=4.0×10-38,Ksp(CuS)=6.3×10-36,Ksp(MnS)=4.65×10-14.下列推断不正确的是( )
| A. | 加入MnCO3的目的是除去Fe3+ | |
| B. | 常温下,pH=4时,Fe3+已除尽 | |
| C. | 反应Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=1.35×1022 | |
| D. | Mn2(OH)2CO3、Mn(OH)2都可以替代MnCO3 |
3.某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、Fe3+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取溶液进行连续实验,实验过程及产物如下:下列结论正确的是( )
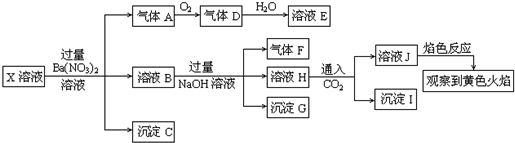

| A. | 溶液J焰色反应显黄色,则说明原溶液中存在Na+ | |
| B. | 沉淀G中加入盐酸溶解,滴加一滴KSCN溶液显红色,可以确定原溶液中有Fe3+ | |
| C. | X中不能确定的离子是 A13+、Fe3+、Na+、K+和C1- | |
| D. | 沉淀I一定是Al(OH )3 |
10.0.5LNaOH溶液中有2gNaOH,则此溶液的物质的量浓度为( )
| A. | 0.05mol•L-1 | B. | 0.1 mol•L-1 | C. | 0.5 mol•L-1 | D. | 1 mol•L-1 |
7.已知:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol
②
下列说正确的是( )
①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol
②

下列说正确的是( )
| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H一O键比H一N键弱 |
4.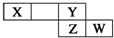 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:Y>Z | |
| B. | Z的最高价氧化物对应水化物是强酸 | |
| C. | X元素的最简单氢化物与Y元素形成的化合物溶于水会促进水的电离. | |
| D. | 已知HY沸点远高于HZ,因为H-Y键的键能高于H-Z键. |
 青霉素是最重要的抗生索.青霉素在人体内经酸性水解后.得到青霉素氨基酸,其结构筒式如图所示.
青霉素是最重要的抗生索.青霉素在人体内经酸性水解后.得到青霉素氨基酸,其结构筒式如图所示.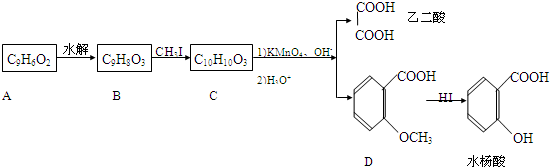

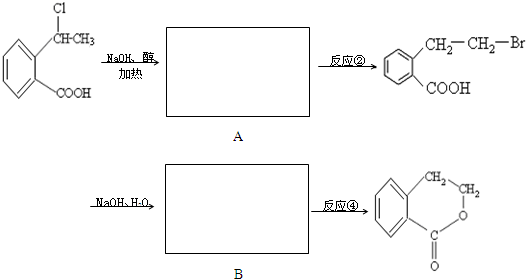
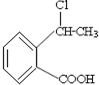 合成
合成 的反应流程图,请在方框内写出A与
的反应流程图,请在方框内写出A与