题目内容
17.下列A~I九种物质之间的转化关系如图所示,其中部分生成物或反应条件已略去.已知A在常温下为黑色固体单质,常温下C、E、F都是无色气体.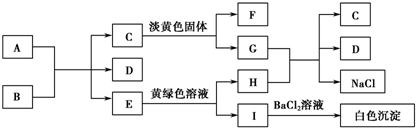
请回答下列问题:
(1)A固体是C,B的化学式是H2SO4.
(2)C与淡黄色固体反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2.
(3)E转变为H和I的离子方程式是SO2+Cl2+2H2O═4H++2Cl-+SO42-;G与H反应的离子方程式是CO32-+2H+=CO2↑+H2O.
分析 根据图中各物质转化关系,A为固态单质,常温下C、E、F都是无色气体,则A与B的反应应为碳与浓酸硫或浓硝酸的反应,E能与黄绿色溶液(应为氯水)反应,生成I遇氯化钡有白色沉淀,则I中应含有硫酸根,I为H2SO4,H为HCl,所以A与B的反应为碳与浓硫酸的反应,A为C,B为浓H2SO4,E为SO2,D为H2O,C是气体能与淡黄色固体反应,则应为二氧化碳与过氧化钠的反应,所以C为CO2,F为O2,G为Na2CO3,HCl与Na2CO3反应生成二氧化碳、氯化钠和水,符合各物质转化关系,据此答题.
解答 解:根据图中各物质转化关系,A为固态单质,常温下C、E、F都是无色气体,则A与B的反应应为碳与浓酸硫或浓硝酸的反应,E能与黄绿色溶液(应为氯水)反应,生成I遇氯化钡有白色沉淀,则I中应含有硫酸根,I为H2SO4,H为HCl,所以A与B的反应为碳与浓硫酸的反应,A为C,B为浓H2SO4,E为SO2,D为H2O,C是气体能与淡黄色固体反应,则应为二氧化碳与过氧化钠的反应,所以C为CO2,F为O2,G为Na2CO3,HCl与Na2CO3反应生成二氧化碳、氯化钠和水,符合各物质转化关系,
(1)依据上述分析可知,A为C,B为浓H2SO4 ,
故答案为:C,H2SO4;
(2)C为二氧化碳,题中淡黄色固体为过氧化钠,和二氧化碳气体反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)E转变为H和I的离子方程式是SO2+Cl2+2H2O═4H++2Cl-+SO42-,G为Na2CO3,H为HCl,反应的离子方程式为:CO32-+2H+=CO2↑+H2O,
故答案为:SO2+Cl2+2H2O═4H++2Cl-+SO42-,CO32-+2H+=CO2↑+H2O;
点评 本题考查无机物的推断,题目难度中等,物质的颜色为解答该题的突破口,注意把握反应的转化关系的重要信息,侧重于学生分析能力的考查,注意相关知识的学习.

| A. | 充分利用太阳能 | |
| B. | 因地制宜开发利用风能、水能、地热能、潮汐能 | |
| C. | 合理、安全开发利用氢能、核能 | |
| D. | 煤的汽化与液化不能提高燃料燃烧效率 |
| A. | 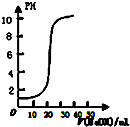 表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线 | |
| B. | 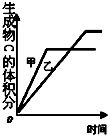 表示压强对可逆反应2A (g)+B (g)?3C (g)+D (s)的影响且甲的比乙的压强大 | |
| C. | 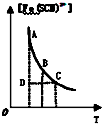 表示可逆反应Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)平衡时,物质的量浓度[Fe(SCN)2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆) | |
| D. | 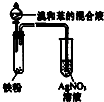 所示装置可证明溴与苯发生取代反应 |
| A. | H2O | B. | NH4Cl | C. | NaOH | D. | Na2O2 |
| 选项 | 实验操作 | 现 象 | 结 论 |
| A | 在试管中滴入适量C2H5X与NaOH溶液,振荡、加热、静置分层后,取水层加稀硝酸酸化,再滴加数滴AgNO3溶液 | 生成淡黄色沉淀 | 证明卤代烃中含有溴元素 |
| B | 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口 | 有大量白烟 | 该无机酸一定为盐酸 |
| C | 将澄清石灰水滴入可能混有Na2CO3的NaHCO3溶液中 | 有白色沉淀产生 | 该溶液中一定含有Na2CO3 |
| D | 在简易启普发生器中向石灰石中加入浓醋酸,将产生的气体直接通入Na2SiO3溶液中 | 硅酸钠溶液产生白色胶状物质 | 酸性:醋酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 9种 | B. | 15种 | C. | 45种 | D. | 50种 |
| A. | 加入MnCO3的目的是除去Fe3+ | |
| B. | 常温下,pH=4时,Fe3+已除尽 | |
| C. | 反应Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=1.35×1022 | |
| D. | Mn2(OH)2CO3、Mn(OH)2都可以替代MnCO3 |
①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol
②

下列说正确的是( )
| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H一O键比H一N键弱 |
 ;
;