题目内容
16. 人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为:
人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为:N2(g)+3H2O(l)═2NH3(g)+3/2O2(g)△H=+765.0kJ•mol?1
回答下列问题:
(1)请在图一所示的坐标中,画出上述反应在有催化剂和无催化剂两种情况下的反应体系能量变化示意图,并进行标注(标注出“反应物”、“生成物”、“有催化剂”、“无催化剂”).
(2)目前工业合成氨的原理是:
N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g)△H=-192.0kJ•mol?1
①反应2H2(g)+O2(g)═2H2O(l)的△H=-319.0 kJ•mol?1.
②某条件下,在容积为2.0L的密闭容器中充入0.6mol N2(g)和1.6mol H2(g),经过2min反应达到平衡,此时NH3的物质的量分数为4/7.则反应在2min内N2的平均反应速率为0.1mol•L-1•min-1,该条件下H2的平衡转化率为75%,平衡常数K=200.
③670K、30Mpa下,n(N2)和n(H2)随时间变化的关系如图二所示,下列叙述正确的是AD.
A.a点的正反应速率比b点大
B.c点处反应达到平衡
C.d点(t1时刻)和e点(t2时刻)处n(N2)不一样
D.其它条件不变,773K下反应至t1时刻,n(H2)比图二中d点的值大
(3)将反应得到的氨气液化为液氨,已知液氨中存在着下列平衡:2NH3?NH4++NH2-.科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与CsOH反应的化学方程式8NH3+4CsOH=N4+4CsNH2+6H2↑+4H2O.
分析 (1)催化剂通过改变反应的活化能,加快反应速率,不影响化学平衡移动的方向;
(2)①已知①N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.0kJ/mol.
②N2(g)+3H2(g)?2NH3(g)△H=-192.0kJ/mol,利用盖斯定律将$\frac{(②-①)×2}{3}$计算焓变;
②令参加反应的氮气的物质的量为amol,利用三段式表示出各物质的变化量、平衡时物质的量,利用压强之比等于物质的量之比列方程计算a,依据反应速率概念就是V=$\frac{△c}{△t}$,转化率=$\frac{消耗量}{起始量}$×100%,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积计算得到;
③根据图象中图象的变化来判断个选项;
(3)根据液氨的电离产物和题目给出的反应物来推断反应方程式.
解答 解:(1)加入催化剂可以降低反应的活化能,从而能够降低反应的能量,同时又能加快反应速率,达到化学平衡的所需时间减小,但是不影响反应中的热效应,有催化剂和无催化剂两种情况下的反应体系能量变化示意图为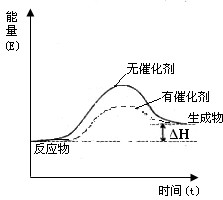 ,故答案为:
,故答案为: ;
;
(2)①已知①N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.0kJ/mol.
②N2(g)+3H2(g)?2NH3(g)△H=-192.0kJ/mol,利用盖斯定律将$\frac{(②-①)×2}{3}$得2H2(g)+O2(g)═2H2O(l)的△H=$\frac{(-192-765)×2}{3}$=-319.0kJ•mol?1,
故答案为:-319.0;
②令参加反应的氮气的物质的量为amol,则:
N2(g)+3H2(g)═2NH3(g)
开始(mol):0.6 1.6 0
转化(mol):a 3a 2a
平衡(mol):0.6-a 1.6-3a 2a
故$\frac{2a}{0.6+1.6-2a}$=$\frac{4}{7}$,解得a=0.4
氮气的反应速率=$\frac{\frac{0.4mol}{2L}}{2min}$=0.1 mol•L-1•min-1;
氢气的转化率=$\frac{3×0.4}{1.6}$×100%=75%;
平衡常数K=$\frac{(\frac{0.8}{2}){\;}^{2}}{\frac{0.2}{2}×(\frac{0.4}{2}){\;}^{3}}$=200,
故答案为:0.1 mol•L-1•min-1; 75%;200;
③A.a、b、c三点均向正反应方向移动,故正反应速率大于逆反应速率,故A正确;
B.当两种物质的物质的量不变时,达到化学平衡状态,所以,c点未达平衡状态,故B错误;
C.d、e均达到化学平衡状态,故各物质的物质的量不再发生变化,故C错误;
D.△H<0,反应放热,升高温度平衡向逆反应方向移动,故773K时,n(H2)大于图中d点,故D正确;
故答案为:AD;
(3)因为Cs+是阳离子,必须要找阴离子配对,阴离子题目提示了,2NH3?NH4++NH2-,所以为:CSNH2.产物还有N4、H2O(因为用到了吸水剂),看元素组成,右边H比较少,一般就是想到H2,反应为8NH3+4CsOH=N4+4CsNH2+6H2↑+4H2O,故答案为:8NH3+4CsOH=N4+4CsNH2+6H2↑+4H2O.
点评 本题考查较综合,涉及知识点较多,涉及通过图象分析化学反应速率、化学平衡及计算、平衡常数的计算应用以及热化学方程式和盖斯定律计算等问题,主要是图象分析判断,平衡移动原理的理解应用,为高频考点,侧重于学生的分析能力和计算能力的考查,需要学生较强的观察能力及思维能力,难度中等.

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案| A. | 加入MnCO3的目的是除去Fe3+ | |
| B. | 常温下,pH=4时,Fe3+已除尽 | |
| C. | 反应Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=1.35×1022 | |
| D. | Mn2(OH)2CO3、Mn(OH)2都可以替代MnCO3 |
①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol
②

下列说正确的是( )
| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H一O键比H一N键弱 |
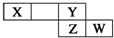 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:Y>Z | |
| B. | Z的最高价氧化物对应水化物是强酸 | |
| C. | X元素的最简单氢化物与Y元素形成的化合物溶于水会促进水的电离. | |
| D. | 已知HY沸点远高于HZ,因为H-Y键的键能高于H-Z键. |
| A. | 柴油、汽油、牛油、植物油等属于烃类物质 | |
| B. | 含五个碳原子的有机物,分子中最多可形成四个碳碳单键 | |
| C. |  是某有机物与H2发生加成反应后的产物.符合该条件的稳定有机物共有3种 是某有机物与H2发生加成反应后的产物.符合该条件的稳定有机物共有3种 | |
| D. | 结构片段为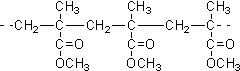 的高聚物,是其单体通过缩聚反应生成 的高聚物,是其单体通过缩聚反应生成 |
| A. | 正极反应为4OH-═O2+2H2O+4e- | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池供应1 mol水蒸气,转移电子4 mol | |
| D. | 氢氧燃料电池的H2和O2都贮存于电池中 |
| A. | 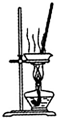 装置可用于蒸干氯化铝溶液制A1C13 | |
| B. | 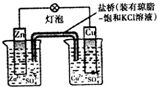 装置盐桥中的K+自右向左移动 | |
| C. | 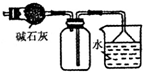 装置可用于收集NH3或HCl气体,并防止倒吸 | |
| D. |  装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
| A. | 61 | B. | 27 | C. | 88 | D. | 34 |
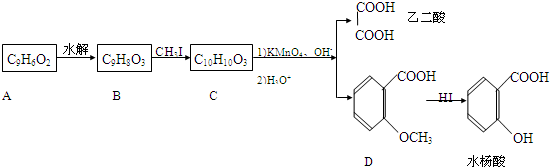
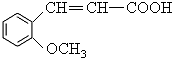
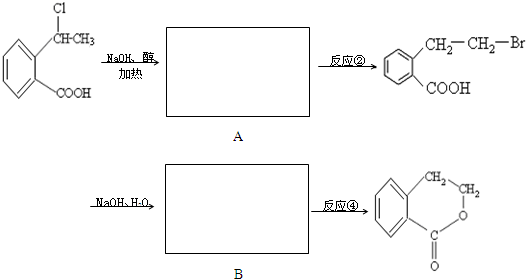
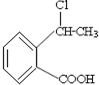 合成
合成 的反应流程图,请在方框内写出A与
的反应流程图,请在方框内写出A与