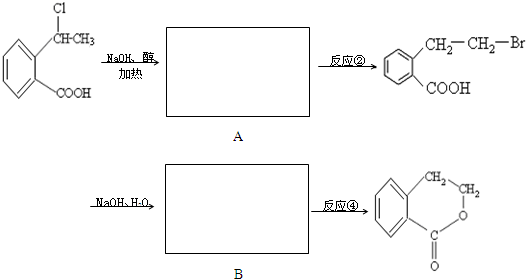
题目内容
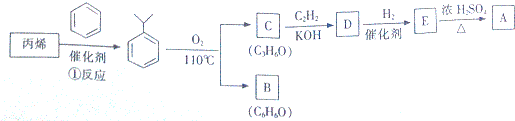
17.丙烯是石油的裂解之一,工业上可用它制得合成中间体A、B.下列是合成路线之一,A的结构简式为 .
.
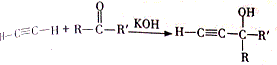
已知:
请回答下列问题;
(1)①反应产物的分子式为C9H12;由A可合成橡胶
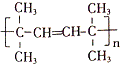 ,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.
,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.(2)丙烯也可由“2-溴丙烷”在某条件下一步反应制得,请写出该化学反应方程式CH3CHBrCH3+NaOH$→_{△}^{醇}$CH2=CHCH3↑+NaBr+H2O.
(3)C与C2H2合成D的化学方程式为
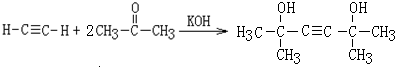 .
.(4)已知:R″CHO+RCH2CHO$\stackrel{NaOH/△}{→}$
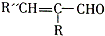 +H2O
+H2O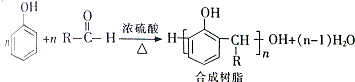
①G有如下转化:
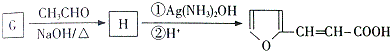
由B和G在浓硫酸条件下合成树脂X,则X的结构简式为
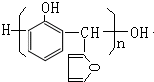 .
.②写出符合下列要求的
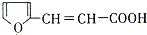 的所有同分异构体的结构简式
的所有同分异构体的结构简式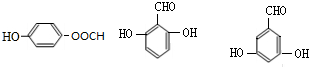 .
.ⅰ与FeCl3溶液发生显色反应;ⅱ能发生银镜反应;ⅲ核磁共振氢谱中有四种峰,且无-O-O结构.
分析 在催化剂条件下,丙烯和苯发生加成反应生成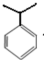 ,
, 发生氧化反应生成B和C,
发生氧化反应生成B和C,
C和乙炔能发生反应生成D,根据题给信息及C的分子式知,C是 ,(1)中B遇FeCl3溶液显紫色,结合B的分子式可知B为
,(1)中B遇FeCl3溶液显紫色,结合B的分子式可知B为 .丙酮和乙炔发生加成反应生成D,
.丙酮和乙炔发生加成反应生成D,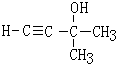 ,D和氢气发生加成反应生成E,E发生消去反应生成A,结合A的结构简式,则D的结构简式为
,D和氢气发生加成反应生成E,E发生消去反应生成A,结合A的结构简式,则D的结构简式为 、E的结构简式为
、E的结构简式为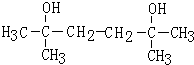 .
.
(4)①G和乙醛反应生成H,H和银氨溶液反应然后酸化生成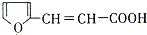 ,所以H为
,所以H为 ,根据题给信息知,G的结构简式为:
,根据题给信息知,G的结构简式为: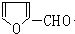 ,B的分子式是C6H6O,可与NaOH溶液反应,B与G在一定条件下反应生成合成树脂X,则X的结构简式为:
,B的分子式是C6H6O,可与NaOH溶液反应,B与G在一定条件下反应生成合成树脂X,则X的结构简式为: ;
;
②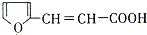 有多种同分异构体,符合下列要求的同分异构体:
有多种同分异构体,符合下列要求的同分异构体:
i能与FeCl3溶液反应显紫色,含有酚羟基,ii能发生银境反应,含有醛基,ⅲ核磁共振氢谱中有四种峰,醛基、酚羟基个含有1种H原子,则苯环应含有2种H原子,且无-O-O结构,侧链为-OOCH、-OH且处于对位,或侧链为2个-OH、1个-CHO,3个取代基处于间位,或处于邻位且-CHO位于2个-OH之间.
解答 解:在催化剂条件下,丙烯和苯发生加成反应生成 ,
, 发生氧化反应生成B和C,
发生氧化反应生成B和C,
C和乙炔能发生反应生成D,根据题给信息及C的分子式知,C是 ,(1)中B遇FeCl3溶液显紫色,结合B的分子式可知B为
,(1)中B遇FeCl3溶液显紫色,结合B的分子式可知B为 .丙酮和乙炔发生加成反应生成D,
.丙酮和乙炔发生加成反应生成D,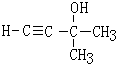 ,D和氢气发生加成反应生成E,E发生消去反应生成A,结合A的结构简式,则D的结构简式为
,D和氢气发生加成反应生成E,E发生消去反应生成A,结合A的结构简式,则D的结构简式为 、E的结构简式为
、E的结构简式为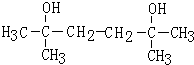 .
.
(1)①反应产物为 ,分子式为C9H12;由A可合成橡胶
,分子式为C9H12;由A可合成橡胶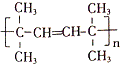 ,该反应的类型是:加聚反应;B遇FeCl3溶液显紫色,分子式是C6H6O,则B是苯酚,
,该反应的类型是:加聚反应;B遇FeCl3溶液显紫色,分子式是C6H6O,则B是苯酚,
故答案为:C9H12;加聚反应;苯酚;
(2)2-溴丙烷在氢氧化钠醇溶液、加热条件下发生消去反应应生成丙烯,该化学反应方程式为:CH3CHBrCH3+NaOH$→_{△}^{醇}$CH2=CHCH3↑+NaBr+H2O,
故答案为:CH3CHBrCH3+NaOH$→_{△}^{醇}$CH2=CHCH3↑+NaBr+H2O;
(3)C与C2H2合成D的化学方程式是: ,
,
故答案为: ;
;
(4)①G和乙醛反应生成H,H和银氨溶液反应然后酸化生成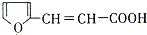 ,所以H为
,所以H为 ,根据题给信息知,G的结构简式为:
,根据题给信息知,G的结构简式为: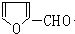 ,B的分子式是C6H6O,可与NaOH溶液反应,B与G在一定条件下反应生成合成树脂X,则X的结构简式为:
,B的分子式是C6H6O,可与NaOH溶液反应,B与G在一定条件下反应生成合成树脂X,则X的结构简式为: ,故答案为:
,故答案为: ;
;
②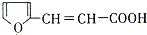 有多种同分异构体,符合下列要求的同分异构体:
有多种同分异构体,符合下列要求的同分异构体:
i能与FeCl3溶液反应显紫色,含有酚羟基,ii能发生银境反应,含有醛基,ⅲ核磁共振氢谱中有四种峰,醛基、酚羟基个含有1种H原子,则苯环应含有2种H原子,且无-O-O结构,侧链为-OOCH、-OH且处于对位,或侧链为2个-OH、1个-CHO,3个取代基处于间位,或处于邻位且-CHO位于2个-OH之间,符合条件同分异构体有: ,
,
故答案为: .
.
点评 本题考查有机物的推断,注意结合题给信息、有机物的分子式与A的结构采用正、逆推法相结合进行分析推断,侧重考查学生的分析推理能力与知识迁移运用能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol
②

下列说正确的是( )
| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H一O键比H一N键弱 |
| A. |  装置可用于蒸干氯化铝溶液制A1C13 | |
| B. | 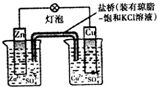 装置盐桥中的K+自右向左移动 | |
| C. | 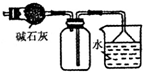 装置可用于收集NH3或HCl气体,并防止倒吸 | |
| D. |  装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
H2CrO4═HCrO${\;}_{4}^{-}$+H+
HCrO${\;}_{4}^{-}$?CrO${\;}_{4}^{2-}$+H+ Ka=3.2×10-7mol.L-1
下列判断正确的是( )
| A. | 0.05 mol•L-1H2CrO4溶液的pH=1 | |
| B. | 向100 mL0.l mol•L-1 H2CrO4溶液中滴入几滴NaOH溶液,溶液中$\frac{c(Cr{O}_{4}^{2-})}{c(HCr{O}_{4}^{-})}$变大 | |
| C. | Na2CrO4溶液中:c(Na+)+c(H+)=c(CrO42-)+c(HCrO4-)+c(OH-) | |
| D. | 等浓度的:NaHCrO4溶液与NaHCO3溶液中,水的电离程度前者大 |
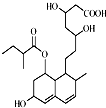 一种调节血脂的药物普伐他汀,其结构简式如图所示.下列有关普伐他汀说法正确的是( )
一种调节血脂的药物普伐他汀,其结构简式如图所示.下列有关普伐他汀说法正确的是( )| A. | 不能使酸性KMnO4溶液褪色,但能与FeCl3溶液发生显色反应 | |
| B. | 含有4种含氧官能团 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与5molNaOH反应 |
 利用图所示装置进行以下实验,能得到相应实验结论的是( )
利用图所示装置进行以下实验,能得到相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | 石灰石 | 澄清石灰水 | 制二氧化碳并吸收尾气 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | H2S溶液 | SO2具有还原性 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 61 | B. | 27 | C. | 88 | D. | 34 |
(1)上述实验中发生反应的离子方程式有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 | A | B | C | D | E | F | |
| 混 合 溶 液 | 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 | |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 | |
| 时间(min) | 15 | 10 | 5 | 3 | 6 | 9 | |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在Zn表面,降低了Zn与溶液接触的表面,使得氢气的生成速率反而下降;
(3)改用锌粉与稀硫酸反应,加入少量硫酸铜溶液后充分振荡,一段时间剩余少量固体.该同学对固体成分提出下列假设:
假设1:全部为铜;
假设2:既有Zn又有Cu.
(4)请你设计实验验证上述假设1,完成下表内容.
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| , |
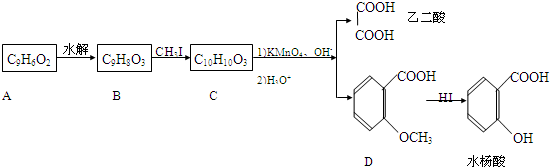

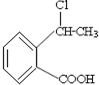 合成
合成 的反应流程图,请在方框内写出A与
的反应流程图,请在方框内写出A与