题目内容
19.A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.请回答下列问题.(1)元素D在周期表中的位置第三周期第ⅠA族.
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)S2->O2->Na+.
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有离子键、共价键.用电子式表示当C、D按1:1所组成化合物的形成过程
 .
.(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(5)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:SiO2+2OH-=SiO3 2-+H2O.
分析 C元素的原子最外层电子数是次外层电子数的三倍,且是短周期元素,所以C是O元素,C与F同主族,且是短周期元素,所以F是S元素,D与E和F同周期,都处于第三周期,且D是所在周期原子半径最大的主族元素,所以D是Na元素,E的原子序数大于钠小于硫,所以E的单质是固体,六种元素所形成的常见单质在常 温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素,A的单质是气体,则A的原子序数最小,所以A是H元素,
(1)D是Na元素,钠原子核外有3个电子层,最外层有1个电子;
(2)电子层数越多,离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小;
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X为NH4NO3;C、D按1:1所组成化合物为过氧化钠,过氧化钠为离子化合物,O原子和Na原子之间形成共用电子对;
(4)若E是金属元素,则为Al元素,铝和氧化铁能发生铝热反应;
(5)若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素.
解答 解:C元素的原子最外层电子数是次外层电子数的三倍,且是短周期元素,所以C是O元素,C与F同主族,且是短周期元素,所以F是S元素,D与E和F同周期,都处于第三周期,且D是所在周期原子半径最大的主族元素,所以D是Na元素,E的原子序数大于钠小于硫,所以E的单质是固体,六种元素所形成的常见单质在常 温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素,A的单质是气体,则A的原子序数最小,所以A是H元素,
(1)D是Na元素,钠原子核外有3个电子层,最外层有1个电子,所以其在元素周期表中的位置是第三周期第IA族,
故答案为:第三周期第IA族;
(2)电子层数越多,离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以C、D、F三种元素形成的简单离子的半径由大到小的顺序是S 2->O 2->Na+,
故答案为:S 2->O 2->Na+;
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X为NH4NO3,硝酸铵中所含化学键类型有离子键和共价键;C、D按1:1所组成化合物为过氧化钠,过氧化钠为离子化合物,O原子和Na原子之间形成共用电子对,用电子式表示过氧化钠的形成过程为 ;
;
故答案为:离子键、共价键; ;
;
(4)若E是金属元素,则为Al元素,铝和氧化铁能发生铝热反应,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(5)若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,二氧化硅和强碱反应生成硅酸盐和水,离子反应方程式为:SiO2+2OH-=SiO3 2-+H2O,
故答案为:SiO2+2OH-=SiO3 2-+H2O.
点评 本题考查元素位置、结构和性质,正确推断元素是解本题关键,注意把握用电子式表示物质形成过程的方法,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

| A. | 9种 | B. | 15种 | C. | 45种 | D. | 50种 |
| A. | 0.05mol•L-1 | B. | 0.1 mol•L-1 | C. | 0.5 mol•L-1 | D. | 1 mol•L-1 |
①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol
②

下列说正确的是( )
| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H一O键比H一N键弱 |
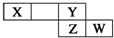 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:Y>Z | |
| B. | Z的最高价氧化物对应水化物是强酸 | |
| C. | X元素的最简单氢化物与Y元素形成的化合物溶于水会促进水的电离. | |
| D. | 已知HY沸点远高于HZ,因为H-Y键的键能高于H-Z键. |
| A. | 柴油、汽油、牛油、植物油等属于烃类物质 | |
| B. | 含五个碳原子的有机物,分子中最多可形成四个碳碳单键 | |
| C. |  是某有机物与H2发生加成反应后的产物.符合该条件的稳定有机物共有3种 是某有机物与H2发生加成反应后的产物.符合该条件的稳定有机物共有3种 | |
| D. | 结构片段为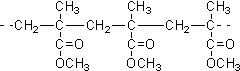 的高聚物,是其单体通过缩聚反应生成 的高聚物,是其单体通过缩聚反应生成 |
| A. | 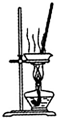 装置可用于蒸干氯化铝溶液制A1C13 | |
| B. | 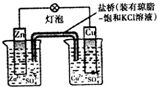 装置盐桥中的K+自右向左移动 | |
| C. | 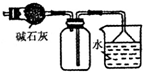 装置可用于收集NH3或HCl气体,并防止倒吸 | |
| D. |  装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
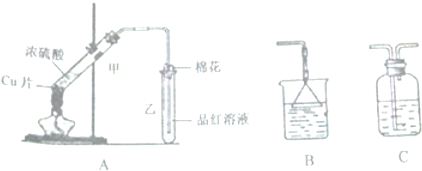
 利用图所示装置进行以下实验,能得到相应实验结论的是( )
利用图所示装置进行以下实验,能得到相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | 石灰石 | 澄清石灰水 | 制二氧化碳并吸收尾气 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | H2S溶液 | SO2具有还原性 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |