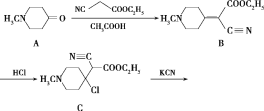
题目内容
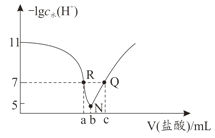
【题目】有Ⅰ~Ⅳ四个体积均为 0.5 L 的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入 HCl 和 O2(如下表),加入催化剂发生反应 4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
容器 | 起始时 | ||
t/℃ | n(HCl)·mol-1 | Z | |
I | 300 | 0.25 | a |
II | 300 | 0.25 | b |
III | 300 | 0.25 | 4 |
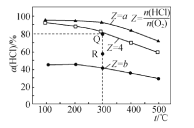
A.ΔH<0,b<4<a
B.300 ℃该反应的平衡常数的值为 64
C.容器Ⅲ某时刻处在 R 点,则 R 点的 v 正>v 逆,压强:p(R)>p(Q)
D.若起始时,在容器Ⅳ中充入 0.25 mol Cl2 和 0.25 mol H2O(g),300 ℃达平衡时容器中 c(HCl)=0.1 mol·L-1
【答案】C
【解析】
A. 根据图示,升高温度,平衡转化率α(HCl)减小,说明平衡逆向移动,正反应放热,ΔH<0,增大氯化氢的投料,氯化氢转化率减小,所以b>4>a,故A错误;
B.根据Z=4的曲线, 300 ℃时,平衡转化率α(HCl)=80%,

![]() 640,故B错误;
640,故B错误;
C. 容器Ⅲ某时刻处在 R 点,300 ℃时Q为平衡点,由R到Q,氯化氢的质量增大,反应正向进行,则 R 点的 v 正>v 逆,正反应气体物质的量减小,所以压强:p(R)>p(Q),故C正确;
D.若起始时,在容器Ⅳ中充入 0.25 mol Cl2 和 0.25 mol H2O(g),根据一边倒的原则,相当于加入了0.5 mol Cl2 和 0.125 mol O2(g),投料为容器Ⅲ的2倍,相当于加压,300 ℃达平衡时,0.2 mol·L-1>c(HCl)>0.1 mol·L-1,故D错误。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目