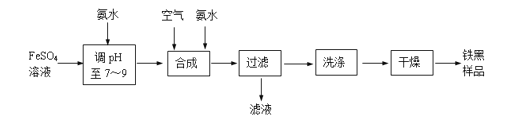
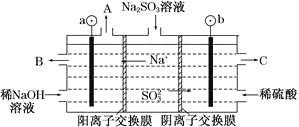
题目内容
【题目】常温下,向20.00mL0.1mol·L-1氨水中滴入0.1mol·L-1 盐酸,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加盐酸体积的关系如图所示,下列说法正确的是( )
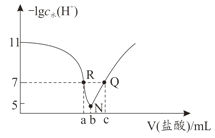
A.常温下,Kb(NH3·H2O)约为1×10-3
B.b=20.00
C.R、Q两点对应溶液均呈中性
D.R到N、N到Q所加盐酸体积相等
【答案】B
【解析】
A.常温下,未加盐酸的氨水的-lgc水(H+)=11,则该溶液中水电离出的c(H+)=c(OH-)=10-11mol/L,溶液中c(OH-)=![]() mol/L=10-3mol/L,c(NH3H2O)≈0.1mol/L,Kb(NH3H2O)=
mol/L=10-3mol/L,c(NH3H2O)≈0.1mol/L,Kb(NH3H2O)=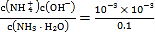 =1×10-5,A错误;
=1×10-5,A错误;
B.当-lgc水(H+)最小时,HCl与氨水恰好完全反应,所以b点NaOH溶液体积为20.00mL,B正确;
C. N点水电离出的H+浓度最大,溶液呈中性,R点碱过量,溶液呈碱性。Q点溶质为HCl和NH4Cl,溶液呈酸性,C错误;
D.R点氨水略过量,R→N加HCl消耗一水合氨,促进水的电离;N→Q加HCl,酸过量,抑制水的的电离,所以R到N、N到Q所加盐酸体积不相等,D错误;
故合理选项是B。

【题目】有Ⅰ~Ⅳ四个体积均为 0.5 L 的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入 HCl 和 O2(如下表),加入催化剂发生反应 4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
容器 | 起始时 | ||
t/℃ | n(HCl)·mol-1 | Z | |
I | 300 | 0.25 | a |
II | 300 | 0.25 | b |
III | 300 | 0.25 | 4 |
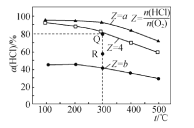
A.ΔH<0,b<4<a
B.300 ℃该反应的平衡常数的值为 64
C.容器Ⅲ某时刻处在 R 点,则 R 点的 v 正>v 逆,压强:p(R)>p(Q)
D.若起始时,在容器Ⅳ中充入 0.25 mol Cl2 和 0.25 mol H2O(g),300 ℃达平衡时容器中 c(HCl)=0.1 mol·L-1