题目内容
【题目】下列说法正确的是
A.常温下,向0.1 mol·L1 CH3COONa中加入少量水,溶液中![]() 比值减小
比值减小
B.用0.1 mol·L1 NaOH溶液分别中和等体积等pH的盐酸和醋酸,盐酸消耗NaOH溶液的体积大
C.常温下,pH=10的氨水中,由水电离出的OH-浓度为1×10-4mol·L1
D.常温下,向10 mL pH=2的盐酸中分别加入V1 mL的水和V2 mL pH=12的NaOH溶液,所得溶液的pH均为3,忽略混合时溶液体积的变化,则V1∶V2=11∶1
【答案】D
【解析】
A. 加水促进CH3COO-的水解;
B. 等pH的盐酸和醋酸,醋酸的浓度大于盐酸的浓度;
C. 常温下,pH=10的氨水中,由水电离出的H+浓度为![]() =10-3mol/L,由水电离出的H+浓度与由水电离出的OH-浓度相等;
=10-3mol/L,由水电离出的H+浓度与由水电离出的OH-浓度相等;
D. 盐酸中c(H+)为0.01mol/L,加水稀释,溶质的物质的量不变,加入氢氧化钠溶液后根据混合后溶液的pH为3计算出需要氢氧化钠的体积,进一步进行计算。
A. 加水促进CH3COO-的水解,溶液中![]() 比值增大,A项错误;
比值增大,A项错误;
B. 等pH的盐酸和醋酸,醋酸的浓度大于盐酸的浓度,因此用0.1 mol·L1 NaOH溶液分别中和等体积等pH的盐酸和醋酸,醋酸消耗NaOH溶液的体积大,B项错误;
C. 常温下,pH=10的氨水中,由水电离出的H+浓度为![]() =10-3mol/L,由水电离出的H+浓度与由水电离出的OH-浓度相等,即由水电离出的OH-浓度为10-3mol/L,C项错误;
=10-3mol/L,由水电离出的H+浓度与由水电离出的OH-浓度相等,即由水电离出的OH-浓度为10-3mol/L,C项错误;
D. 常温下,向10 mL pH=2的盐酸中加入V1 mL的水,c(H+)=![]() =10-3mol/L,解得V1=90ml;向10 mL pH=2的盐酸中加入V2 mL pH=12的NaOH溶液,混合后溶液pH为3,那么c(H+)=
=10-3mol/L,解得V1=90ml;向10 mL pH=2的盐酸中加入V2 mL pH=12的NaOH溶液,混合后溶液pH为3,那么c(H+)=![]() =10-3mol/L,解得V2=
=10-3mol/L,解得V2=![]() ml,因此V1∶V2=11∶1,D项正确;
ml,因此V1∶V2=11∶1,D项正确;
答案选D。

【题目】下列由实验得出的结论正确的是( )
选项 | 实验操作及现象 | 结论 |
A | 甲烷与氯气以体枳比1:1混合在光照下反应生成油状物质 | 油状物质为一氯甲烷 |
B | 将苯加入溴水中,振荡,溴水层为无色 | 苯与Br2发生了加成反应 |
C | 碳酸钠溶液中加入乙酸产生气泡 | 乙酸酸性强于碳酸 |
D | 加热乙醇、冰醋酸及浓硫酸的混合液,有果香味物质生成 | 乙醇与冰醋酸发生了加成反应 |
A.AB.BC.CD.D
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量
【题目】有Ⅰ~Ⅳ四个体积均为 0.5 L 的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入 HCl 和 O2(如下表),加入催化剂发生反应 4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
容器 | 起始时 | ||
t/℃ | n(HCl)·mol-1 | Z | |
I | 300 | 0.25 | a |
II | 300 | 0.25 | b |
III | 300 | 0.25 | 4 |
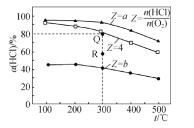
A.ΔH<0,b<4<a
B.300 ℃该反应的平衡常数的值为 64
C.容器Ⅲ某时刻处在 R 点,则 R 点的 v 正>v 逆,压强:p(R)>p(Q)
D.若起始时,在容器Ⅳ中充入 0.25 mol Cl2 和 0.25 mol H2O(g),300 ℃达平衡时容器中 c(HCl)=0.1 mol·L-1
