题目内容
【题目】如图所示中学化学中常见物质的实验转化过程,部分物质和反应条件略去。
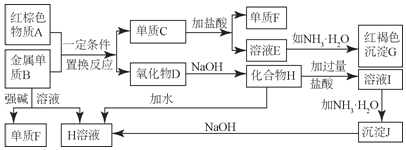
(1)写出F的化学式______;写出物质A的一种用途______;
(2)写出单质B与强碱溶液反应的离子方程式______,写出沉淀J生成H溶液的离子方程式______;
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式______;
(4)溶液I中所含金属离子是______。
【答案】![]() 作油漆颜料,炼铁等
作油漆颜料,炼铁等 ![]()
![]()
![]()
![]() 、
、![]()
【解析】
金属B与强碱反应得到单质F与H,则B为Al、F为![]() ,H为偏铝酸盐,G为红褐色沉淀,则G为
,H为偏铝酸盐,G为红褐色沉淀,则G为![]() ,红棕色物质A与金属Al发生置换反应生成单质C与氧化物D,则A为
,红棕色物质A与金属Al发生置换反应生成单质C与氧化物D,则A为![]() 、C为Fe、D为
、C为Fe、D为![]() ,由转化关系可知,E为
,由转化关系可知,E为![]() ,H为
,H为![]() ,溶液I为NaCl、HCl、
,溶液I为NaCl、HCl、![]() 混合物,J为
混合物,J为![]() ,据此解答。
,据此解答。
(1)由上述分析可知,单质F的化学式是![]() ,物质A为
,物质A为![]() ,可以用作油漆颜料,炼铁等,
,可以用作油漆颜料,炼铁等,
故答案为:![]() ;用作油漆颜料,炼铁等;
;用作油漆颜料,炼铁等;
(2)单质Al与强碱溶液反应的离子方程式:![]() ,由沉淀J生成H溶液的离子方程式为:
,由沉淀J生成H溶液的离子方程式为:![]() ,
,
故答案为:![]() ;
;![]() ;
;
(3)溶液![]() 中加入氨水时,先生成白色沉淀L为
中加入氨水时,先生成白色沉淀L为![]() ,离子方程式:
,离子方程式:![]() ,
,
故答案为:![]() ;
;
(4)溶液I为NaCl、HCl、![]() 混合物,所含金属离子是
混合物,所含金属离子是![]() 、
、![]() ,
,
故答案为:![]() 、
、![]() 。
。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量
【题目】有Ⅰ~Ⅳ四个体积均为 0.5 L 的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入 HCl 和 O2(如下表),加入催化剂发生反应 4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
容器 | 起始时 | ||
t/℃ | n(HCl)·mol-1 | Z | |
I | 300 | 0.25 | a |
II | 300 | 0.25 | b |
III | 300 | 0.25 | 4 |
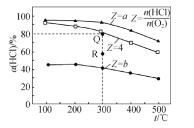
A.ΔH<0,b<4<a
B.300 ℃该反应的平衡常数的值为 64
C.容器Ⅲ某时刻处在 R 点,则 R 点的 v 正>v 逆,压强:p(R)>p(Q)
D.若起始时,在容器Ⅳ中充入 0.25 mol Cl2 和 0.25 mol H2O(g),300 ℃达平衡时容器中 c(HCl)=0.1 mol·L-1