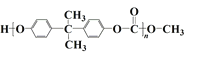
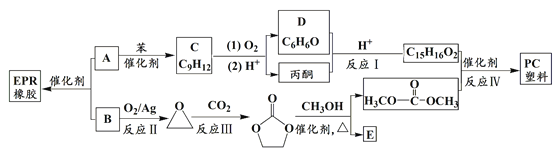
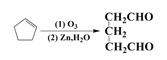
题目内容
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:
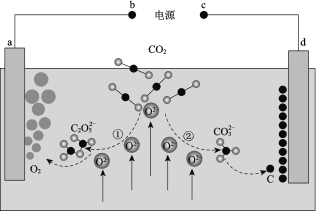
下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
【答案】B
【解析】
A.a电极反应是2C2O52--4e-═4CO2+O2,发生氧化反应,是电解池的阳极,则b为正极,故A正确;B.①捕获CO2时生成的C2O52-中碳元素的化合价仍为+4价,②捕获CO2时生成CO32-时碳元素的化合价仍为+4价,碳元素的化合价均未发生变化,故B错误;C.由电解装置示意图可知a电极反应是2C2O52--4e-═4CO2+O2,故C正确;D.由电解装置示意图可知a电极生成O2,d电极生成C,电解池总反应式为CO2 =C+O2,故D正确;故答案为B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列“试剂”和“烧杯中的物质”不能完成“实验目的”的是
实验目的 | 试剂 | 烧杯中的物质 | |
A | 醋酸的酸性强于苯酚 | 碳酸氢钠溶液 | ①醋酸 ②苯酚溶液 |
B | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯 ②苯酚溶液 |
C | 甲基对苯环的活性有影响 | 酸性高锰酸钾溶液 | ①苯 ②甲苯 |
D | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 | 金属钠 | ①水 ②乙醇 |
A. A B. B C. C D. D
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性溶液中分解产生S、SO2。

Ⅰ. Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得,实验室模拟该工业过程的装置如图所示。
(1)b中反应的离子方程式为________,c中试剂为_________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_______。
(3)实验中要控制SO2生成速率,可以采取的措施有___________(写出两条)。
(4)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______。
(5)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:___________________________________。
Ⅱ. 探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)
Fe(S2O3)33-(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O32-
装置 | 编号 | 试剂X | 实验现象 |
| ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色, 30s后溶液几乎变为无色 |
② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(6)根据实验①的现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过____(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:____。
(7)同浓度氧化性:Ag+ > Fe3+。实验②中Ag+未发生氧化还原反应的原因是____。
(8)进一步探究Ag+和S2O32-反应。
装置 | 编号 | 试剂X | 实验现象 |
| ③ | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:Ag2S2O3+_____ =Ag2S+_____
(9)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和____有关(写出两条)。