��Ŀ����
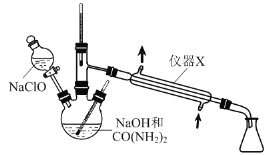
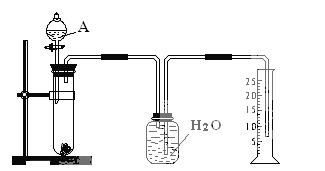
����Ŀ��ijͬѧ�����һ����ʵ�飨��ͼ��ʾ�����Բⶨþ���Ͻ������������������ɹ�ѡ�õ��Լ��У�ŨH2SO4��Ũ���ᡢ6 mol��l-1NaOH��Һ��
����д���пհף�
��1���й�ʵ�������a�����Թ��з������������Ͻ���Ʒ��b���ӷ�Һ©�����Թ��м��������A��Һ��c�����װ�õ������ԣ�d���ⶨ�ռ�����ˮ�������
��ȷ�IJ���˳��Ϊ_________________________________________��
��2��A��Һ��ѡ��________________________________________
��3����ʵ���в����Ʒ������ΪW g �����������Ϊa L����״����������Ʒ��Al����������Ϊ_______________________________________��
���𰸡�cabd 6mol��l-1NaOH��Һ 9a/11.2w��100%
��������
����ˮ���ռ�����,ʵ����ͨ���ⶨ�������������,���ݼ���ȷ���Ͻ���Al����������,
(1)�ռ���������,����ҩƷǰ�ȼ���װ�õ�������,Ȼ����Ƚ����Ͻ�,�ټ�������������Һ,�ⶨ�ռ�����ˮ�����ȷ�����������������
(2)����ˮ���ռ�����,ʵ����ͨ���ⶨ���������������
(3)���������������������Ͻ���Al������,��������Ͻ���Al������������
����ˮ���ռ�����,ʵ����ͨ���ⶨ�������������,���ݼ���ȷ���Ͻ���Al����������,
(1)�ռ���������,����ҩƷǰ�ȼ���װ�õ�������,Ȼ����Ƚ����Ͻ�,�ټ�������������Һ,�ⶨ�ռ�����ˮ�����ȷ���������������,����ȷ�IJ���˳��Ϊcabd,
����:cabd��
(2)����ˮ���ռ�����,ʵ����ͨ���ⶨ�������������,��A���Լ�Ϊ6mol��l-1NaOH��Һ��
����: 6mol��l-1NaOH��Һ��
(3)ʵ���в����Ʒ������ΪWg,���������ΪaL(��״��),��:
2Al+2NaOH+2H2O�T2NaAlO2+3H2��
54g 3��22.4
m(Al) aL
����m(Al)=54��a/3��22.4=18a/22.4g���ʺϽ���Al����������=18a/22.4w��100%=9a/11.2w��100%��
����: 9a/11.2w��100%��

 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�����Ŀ�����������ĸ������Ϊ 0.5 L �ĺ����ܱ��������������������а���ͬͶ�ϱ�(Z)���� HCl �� O2(���±�)���������������Ӧ 4HCl(g)��O2(g) ![]() 2Cl2(g)��2H2O(g) ��H��HCl ��ƽ��ת����(��)�� Z ���¶�(T)�Ĺ�ϵ��ͼ ��ʾ������˵����ȷ����
2Cl2(g)��2H2O(g) ��H��HCl ��ƽ��ת����(��)�� Z ���¶�(T)�Ĺ�ϵ��ͼ ��ʾ������˵����ȷ����
���� | ��ʼʱ | ||
t/�� | n(HCl)��mol��1 | Z | |
I | 300 | 0.25 | a |
II | 300 | 0.25 | b |
III | 300 | 0.25 | 4 |
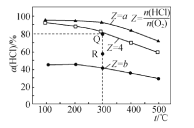
A.��H<0��b<4<a
B.300 ���÷�Ӧ��ƽ�ⳣ����ֵΪ 64
C.������ijʱ�̴��� R �㣬�� R ��� v ��>v �棬ѹǿ��p(R)>p(Q)
D.����ʼʱ�����������г��� 0.25 mol Cl2 �� 0.25 mol H2O(g)��300 ����ƽ��ʱ������ c(HCl)��0.1 mol��L��1