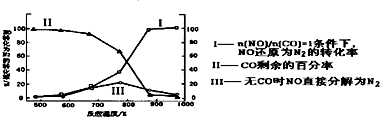
题目内容
6.${\;}_{27}^{61}$Co原子的核内中子数为( )| A. | 61 | B. | 27 | C. | 88 | D. | 34 |
分析 元素符号的左下角数字表示质子数,左上角数字表示质量数,原子中的中子数=质量数-质子数,据此分析解答.
解答 解:6127Co原子的质子数是27,质量数是61,中子数=质量数-质子数=61-27=34,
故选D.
点评 本题考查了原子结构,根据原子中中子数=质量数-质子数即可分析解答本题,难度不大.

练习册系列答案
相关题目
14.乙酸橙花酯的结构简式如图所示,下列叙述中正确的是( )
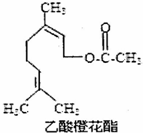

| A. | 该有机物分子式为C12H20O2 | |
| B. | 能发生加成反应和取代反应 | |
| C. | 不能使酸性KMnO4溶液褪色 | |
| D. | 1mol该有机物最多能与2mol NaOH反应 |
18.硼元素在自然界主要以硼酸.硼酸盐和硼硅酸盐存在.请回答下列问题:
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为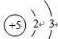 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O7•10H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
①写出硼砂溶液和稀硫酸反应的离子方程式5H2O+B4O72-+2H+=4H3BO3.
②上述流程中获得粗硼酸晶体的操作Ⅰ为降温结晶(冷却热饱和溶液)、过滤,进一步将粗硼酸晶体提纯的方法是重结晶.
③25℃时0.1mol/L硼酸溶液的PH约为5.1,则其电离常数K约为10-9.2.
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为H3BO3═HBO2+H2O.
②硼酸加热到160℃得到的固体的化学式为H2B4O7.(B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显-1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4,其反应方程式为NaBO2+2H2O=2O2↑+NaBH4,则阴极反应式为BO2-+6H2O+8e-=BH4-+8OH-.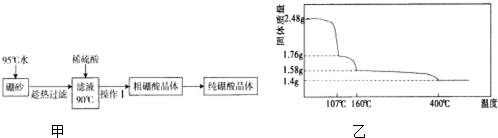
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为
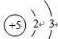 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O7•10H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
②上述流程中获得粗硼酸晶体的操作Ⅰ为降温结晶(冷却热饱和溶液)、过滤,进一步将粗硼酸晶体提纯的方法是重结晶.
③25℃时0.1mol/L硼酸溶液的PH约为5.1,则其电离常数K约为10-9.2.
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为H3BO3═HBO2+H2O.
②硼酸加热到160℃得到的固体的化学式为H2B4O7.(B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显-1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4,其反应方程式为NaBO2+2H2O=2O2↑+NaBH4,则阴极反应式为BO2-+6H2O+8e-=BH4-+8OH-.

11.下列过程中没有发生化学反应的是( )
| A. | 用活性炭去除汽车内室的异味 | |
| B. | 用硝酸对钢船舱进行钝化处理 | |
| C. | 用经硫酸酸化处理的三氧化铬硅胶检验酒精 | |
| D. | 用小苏打溶水拌入面中一起蒸煮使馒头蓬松 |
 人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为:
人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为: .
.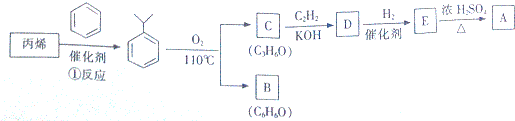
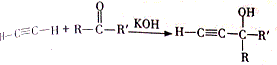
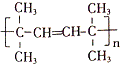 ,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.
,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.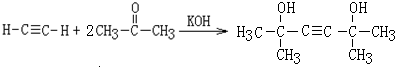 .
.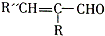 +H2O
+H2O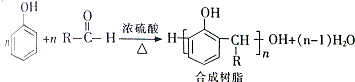
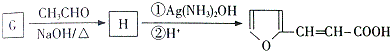
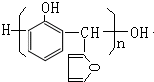 .
.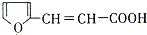 的所有同分异构体的结构简式
的所有同分异构体的结构简式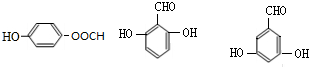 .
. .请回答:
.请回答: